BIOLOGÍA
TEMA 1.Composición de los bioelementos y las biomoléculas.
Composición cuantitativos y cualitativos.
La composición cuantitativa y cualitativa de todos los seres vivos es igual. La composición de los seres vivos no se ha elegido al azar ni por la cantidad de que de ellos haya en el planeta, (el carbono en la corteza terrestre es del 1% mientras que en los seres vivos es del 18%) sino por las propiedades vitales de los elementos para los seres vivos.
Existen 16 elementos comunes existentes en los seres vivos. Todos los elementos que forman parte de los seres vivos tienen en común sus propiedades. Existen dos tipos de composición de los seres vivos según sus propiedades:
-Bioelementos mas del 0.1%
Son el C, N, H, O …. 95%
S, P, Ca, Mg, Cl, Na, K, etc.
-Oligoelementos menos del 0.1%
I, Fe, F, etc. Y pueden variar según unos organismos u otros.
Propiedades de los bioelementos y oligoelementos.
-Tienen bajo peso atómico ya que el el peso atómico es inversamente proporcional a la estabilidad del enlace covalente(enlace de la materia orgánica).
((EL ENLACE COVALENTE , LA TEORÍA DE ENLACE))
Un gas nobles es aquel que tiene la última capa de electrones completa. El resto de los elementos forman enlaces para completar la última capa de electrones. Todo esto sucede para llegar a la estabilidad.
LA TEORÍA DE ENLACE
Los gases nobles, que son estables debido a que tienen la última capa de electrones completa, no forman enlaces mientras los otros átomos sí forman estos enlaces para tener la última capa de electrones completa.
¿Cómo se enlazan los átomos?
- Al Na le faltan 7 átomos y al Cl le falta 1, entonces, el sodio cede el electrón y el cloro lo acepta con carga negativa, se unen y forman el enlace iónico (de baja energía-materia inorgánica)
- A algunos átomos les falta mucho y se unen con otros(los comparte no los pierde) y se crea el enlace covalente y,como le falta mucho, necesita mucha energía para formar este enlace.
- Gracias al enlace covalente se obtiene la energía de los seres vivos = E.QUÍMICA.
Por ejemplo, la molécula del agua es electrónicamente neutra (covalente)y eléctricamente cargada. Es un enlace covalente dativo.
H+ -O H+
(dipolo:Un dipolo eléctrico es un sistema de dos cargas de signo opuesto e igual magnitud cercanas entre sí.)
En la molécula del agua,aunque tiene una carga total neutra, presenta una distribución asimétrica de sus electrones ,lo que le convierte en polar(sin cargas
eléctricas)
-Alto calor específico.(la cantidad de calor que le tengo que dar a un gramo de una sustancia para que aumente un grado.)Y desprende mucho calor cuando se enfría.
El metabolismo es un conjunto de procesos de reacciones químicas para poder realizar el funcionamiento de las células en tiempo real. Todas las reacciones químicas necesitan energía.
La temperatura es una medida de la energía química y la energía química es la agitación de las partículas. El calor no se tiene.
-Amortiguan los cambios de temperatura. En el caso de los iones monovalentes(una carga) como es el Cl- Na+ K+ , son fundamentales en la creación y el mantenimiento de los gradientes eléctricos y químicos.(gradiente: variable que sigue una línea)
-La presión osmótica.La presión osmótica es igual a la cantidad de soluto (concentración de soluto). Los gradientes varían la presión osmótica. El movimiento que crea la presión osmótica se denomina difusión.
Iones divalentes.
Fe Mg++ Mn+ Cu++ Ca++
Aceptan o ceden electrones con mucha facilidad. Son cadenas o ,más bien, cascadas transportadoras de electrones.
Cuando el electrón pierde energía se fabrica ATP. Estos electrones también colaboran con enzimas que catalizan reacciones químicas con las que se intercambian electrones.
- BIOELEMENTOS
-C,H,N,O es el 95% en peso seco.
El carbono y el hidrógeno y el nitrógeno y el oxígeno tienen electronegatividades distintas. Si se mezclan se forman enlaces covalentes dativos(son sustancias polares con cargas eléctricas y son solubles en agua.
- C y N.Se oxidan o se reducen, tienen la misma afinidad.Nunca hay una oxidación sin una reducción y viceversa. A este proceso se le denomina oxidorreducción (redox). Esto implica muchas reacciones metabólicas.Co2 / CH4No3H / NH3
- Carbono C. Tiene esqueleto, toda la materia orgánica está formada por el carbono.(un 18%). En la corteza sólo existe un 1% de C.
- El carbono forma enlaces covalentes consigo mismo y con el resto de los elementos. Si es consigo mismo, tiene un bajo peso atómico ( C-C ..enlace covalente estable). También forma anillos que es igual a la estabilidad de la materia orgánica.
- Los enlaces del carbono son tridimensionales, no son planos asique tiene forma en el espacio.
- Se pueden hacer infinitas cadenas ya que tiene diversas formas que forman anillos y tienen longitud. Gracias a estas infinitas cadenas, hacemos infinitas funciones.
El Silicio es similar al Carbono pero el problema es que el Silicio tiene un alto peso atómico y eso hace que sea inestable. Los enlaces cpvalentes entre Oxígeno y Silicio son muy estables, demasiado, cosa que no es buena, ya que no debe ser ni demasiado estable ni demasiado inestable.
- OLIGOELEMENTOS
Menos del 0.1% son oligelementos
Funciones esenciales.
Su carencia produce enfermedades carenciales y graves trastornos y su exceso es tóxico.
Existe 60 oligoelementos de los cuales 14 son comunes: Fe, Mn, Cu, Zn, F, I, etc.
Fe forma hemoglobina,
I hormona tiroidea(bocio)
F esmalte de huesos y dientes.
Características de las biomoléculas
Del peso total del organismo,el 70% es agua y el 30% es peso seco.
De este peso seco,el 95% es materia orgánica y el 5% son sales minerales.
Biomoléculas:
- Inorgánicas
- agua
- sales minerales
- gases
- Orgánicas
- proteínas
- glúcidos
- lípidos
- ácidos nucleicos
Moléculas orgánicas:
-Son macromoléculas
-Son polímeros (moléculas formadas a partir de otras más pequeñas((monómeros)))
Por ejemplo: los glúcidos son polímeros y están formados por monosacáridos que son monómeros.
Tipos de polímeros:
-Polímeros de mismo monómeros.
- glúcidos
- Almidón = glu-glu-glu-glu... x10^3
- lípidos
- grasa = ac.grasosSirven para (funciones pasivas)-reserva energética... almidón/grasas-estructural(ladrillo)...celulosa /fosfolípidos
-Polimeros de distintos monómeros
- proteínas de 20 aminoácidos distintos
- ácidos nucleicos de 4 nucleótidos distintos
- Tienen una secuencia, esta secuencia determina la forma de la proteína y esa forma determina la función.La secuencia de nucleótidos contienen la información genética.
- Realizan funciones activas
- EL AGUA (H2O)
Los seres humanos estamos formados por un 70% de agua. Pero el porcentaje depende del tipo de organismo y de la edad de este.
-% de agua.
- Tpo de organismos
- medusa (90%)
- lechuga(60%)
- edad
- parte del organismos
- semilla(10%)
- huesos(25%)
- sangre(+ o – 80%)
Forma y estructura
El O2 tiene una electronegatividad muy alta. El H2 tiene una electronegatividad muy baja. Por ello ambos tienen distinta afinidad eléctrica. Forman enlaces covalentes. El oxígeno tiene ocho electrones en la última capa y y le faltan dos para ser estable,entonces el hidrógeno comparte con él dos electrones y así ambos tienen la última capa completa. Los electrones se encuentran más cerca del oxígeno que del hidrógeno. Forman un enlace covalente dativo. Como enlace covalente que son, son electrónicamente neutras pero electrónicamenete cargadas, lo que da lugar al dipolo. Esto explica las propiedades del agua.
H+- -H+ -H+
- - -
- - O-
O- -
H+
Enlaces por puentes de hidrógeno. Los puentes de hidrógeno son enlaces débiles aunque mas fuertes que otras.
Las moléculas de agua forman tetraedros.
Propiedades vitales (debido al dipolo y al PH del agua)y funciones pasivas.
Son anómalas
- Es líquida a temperatura ambiente. Como el Co2, Co, No, (gases). Tienen el mismo peso molecular o parecido pero se encuentran en distintos estados.El agua líquida está ligada a la existencia de la vida.
- Tiene un alto calor específico. (Es el calor necesario que necesita un gramo de cualquier sustancia para que aumente un grado centígrado. La temperatura es la medida de la agitación térmica de las partículas.)Parte del calor se traspasa a la superficie haciendo que se amortigüe la temperatura.En el metabolismo hay muchos cambios de energía sin producir un cambio de temperatura porque las reacciones se producen en el agua.
- Tiene un alto calor de vaporización.(Es la cantidad de calor necesaria para evaporar un gramo de cualquier sustancia)El calor aumenta la temperatura y cuando la presión del vapor es igual a la presión atmosférica se vapora, se necesitan 500 cal/g.Necesita mucho calor para evaporarse. La utilidad que tiene para los seres vivos es que al evaporarse se produce un enfriamiento por transpiración y sirve para el clima. El alto grado de vaporización se explica debido a los puentes de hidrógeno.
- Tiene un alto punto de fusión y una baja densidad en el estado sólido.
El agua se congela a 0ºC y el alcohol etílico (CH5 CH2 OH-) a -144ºC.El
hecho que se congele a temperaturas tan altas permite a que el agua se
encuentre en los 3 estados físicos. El agua tiene menos densidad en estado
sólido que en estado líquido y es por eso por lo que flota.¿Por qué flota?
Cuando las moléculas están establecidas dejan un hueco entre ellas donde se
encuentra aire y es por eso por lo que flota.
La consecuencia que tiene para los seres vivos es que permite a vida bajo el
hielo donde los fondos marinos están fríos.
- Tiene una alta tensión superficial.Es la resistencia que opone un líquido a la introducción de un sólido.(intentas meter algo en el agua y no deja con facilidad.)Esto es porque las moléculas de agua están unidas por los puentes de hidrógeno. La tensión es una medida de la cohesión entre medidas.Para que un cuerpo flote tiene que tener más volumen que masa.Se producen movimientos por corrientes plasmáticos gracias a a tensión.La tensión permite el transporte de la savia bruta por la capilaridad.
Las moléculas de agua están en fila y cada vez que una molécula se expora, mueve a las que van detrás y esto ocurre gracias a la transpiración. La transpiración hace que el agua pase por un capilar gracias a su tensión(sólo si el tubo es fino).
- Disolvente universal (sólo de sustancias polares)Cl- Na+ + H2OEl agua asila las cargas eléctricas y esto hace que se disuelvan los compuesto. La mayoría de moléculas orgánicas son polares y necesitan un medio igual de polar (agua) y esto hace que se disuelvan. Esto les sirven a los seres vivos para formar el medio interno y también sirve como medio de transporte. El agua también influye sobre las sustancias apolares (como en los fosfolípidos) y determina la forma de estos.
Funciones activas del agua.
El agua tiene función activa en las reacciones químicas del metabolismo:
- La hidrólisis (romper enlaces con agua) se produce en muchos enlaces de moléculas orgánicas.
- También se producen reacciones de REDOX (reducción oxidación)gracias al agua y este tiene un papel importante en la fotosíntesis.H20 ----> 2H+ + 2e- + ½ O2 ---> fotolisis(gracias al redox)
- También hace falta agua para sintetizar ácidos grasos.(como los camellos)
Estados físicos de las biomoléculas
- Dispersiones coloidales y disoluciones acuosas.El agua es el principal componente de nuestro medio interno. Nuestras células se encuentran bañadas por el plasma intracelular y dentro de ese plasma por el citosol. El plasma sanguíneo se convierte en plasma intrascelular y vuelve al capilar.
El medio interno es un líquido que rodea las células del cuerpo de los animales constituida por el líquido intersticial de los tejidos, la linfa, el plasma sanguíneo y los líquidos celomáticos y,cuya función es de servir de protección a dichas células, así como de vehículo para el intercambio de sustancias. El medio interno sirve para el mejor funcionamiento.
- Medio interno
- agua
- otras cosas
- disoluciones (Cl Na)
- soluto
- soluble de menos tamaño
- dispersiones coloidales o coloides
- agua +/- soluto +/- grande
- suspensión
- agua + insolubre
sedimentan orgánulos de mayor tamaño.
Homeóstasis: mantenimiento de la constancia de las variables del medio
interno. Cuanto mas Hidrógeno(para el PH), más evolución e independencia.
(se controla)
- Dispersiones coloidales o coloidesel disolvente ahora se llama fase dispersante( agua).el soluto ahora se llama fase dispersa.Se habla de dispersiones coloidales cuando la fase dispersa es más o menos soluble y suficientemente pequeña para dispersarse homogéneamente.Las partículas de la fase dispersa son turbias , filtrables, y no sedimentan ya que la agitación térmica del agua las sostiene.La fase dispersa tiene una alta cantidad de cargas eléctricas y as de mismo signo se repelan,que es también ayuda a que no sedimenten.Hay varios tipos de dispersiones:
- Sólido /líquido en gas.(fase dispersante)P.E. El humo, la niebla, nubes.(aerosoles).
- Menos sólido en más líquido (agua)Cuando la fase dispersa(sólido) sobre la fase dispersante (líquida=agua) se denomina SOL.P.E hialoplasma o citosol, pintura, tinta, etc.Cuando es viceversa se denomina GEL.P.E. Gel de baño, queso, flan, jalea, etc.Si a un sol le añades gel se hace gel y si a un gel le añades sol se hace sol.
- Emulsiones.Mezcla (dispersión) de dos líquidos inmiscibles. P.E. Agua y aceite.
- Ósmosis y presión osmótica.Cuando se forma una disolución o dispersión aparece un movimiento de las moléculas que se igualan las concentraciones, se denomina difusión.La presión osmótica es la que empuja las moléculas y esta es igual a la concentración de soluto o de fase dispersa.
- Ósmosis.Explica la presión osmótica. Es el paso de disolvente desde la disolución más diluida hacia la más concentrada a través de la membrana. Es un proceso mediante el cual se equilibra la concentración de dos disoluciones separadas por una membrana semipermeable mediante el paso de agua del medio más diluido al más concentrado, ya que la presión osmótica del medio más concentrado es mayor que la presión osmótica del medio más diluido. Atrevés de la membrana semipermeable sólo puede pasar agua.(disolvente)
Si se añade jabón la emulsión se queda para siempre. Cuando ocurre esto se dice que la reacción está emulsionada. El aceite actúa como sustancia emulsionante.
P.E. La leche ---> agua + grasa ---> emulsionada con caseína (proteína)
La bilis (sustancia que segrega el hígado) para hacer el mismo efecto (emulsionar)
Membrana semipermeable(membrana intermedia)
-membrana plasmática
-pergamino
-celofán
Cuando la presión hidrostática es igual a la presión osmótica ya no hay más ósmosis.
Medio hipertónico: un medio es hipertónico respecto a otro cuando su concentración de soluto es mayor.
Medio isotónico: dos medios son isotónicos cuando su concentración de soluto son iguales.
Medio hipotónico: un medio es hipotónico cuando su concentración de soluto es menor.
Se utiliza la sal para contrarrestar los cambios de presión osmótica , quita el choque osmótico y hace el medio isotónicos.
Producto iónico del agua ---> escala del PH
El agua es un electrolito( pocas cargas) débil (pocas). 1/550 000 000 moléculas de agua se ioniza gracias al dipolo.
+H3O -HO --->
La fuerza de una carga negativa de una molécula de agua, le arranca un protón a otra molécula de agua.
Disoluciones acuosas y sales minerales.
Producto iónico del agua ---> escala del PH.
2H2O <---> -OH + H+
Cuando el agua es pura a 25ºC , la concentración ( |OH| · |H+|= 10^-14) si.....
uno sube el otro tiene que bajar para que sea la misma cantidad.(cargas positivas y cargas negativas,inversamente proporcionales)
|-OH| · |H+| = 10^-14) ---> 10^-7 · 10 ^-5 = 10^-14 (constante)
Esto se utiliza como referencia para medir el grado de acidez(H+) o el grado de alcalinidad (-OH) de una disolución.
|-OH| = |H+| = |10^-7| (entonces es neutro)
Si es de 1 a 6,es ácido y si es de 8 a 14 es básica.
¿Qué es el PH?
PH = -lg |H+| = -lg 10^-5= 5 ---> así ya no es negativo.
También existe el Poh,¿qué es ?
Poh = -lg |OH| = - lg10 ^-9 = 9
Entre ellas(las unidades) hay 10 veces menos o más.
Ácido / Base
Cuando los ácido /base en una disolución se disocian ,estos se ionizan.
AH<--->A- + H+
BoH <---> b+ + OH-
(las bases de N son las únicas que capturan el H+).
¿Cuándo se ioniza o se disocia una base?
Gracias a K que es la constante de disociación.
K= A- + H+ (forma ionizada)
------------- --------------> ácido o base ,alta o débil ,constante alta
AH (forma sin ionizar) o baja.
Ácido o base fuerte.
Los seres vivos tenemos ácidos y bases bajas, por eso no nos interesan...Los ácidos y bases fuertes en disolución se disocian. También formas disociadas y sin disociar.
Disociado = ionizado = con cargas.
Los ácidos y bases bajos no son necesariamente disociados, ionizado o con carga.
Utilizamos la F(PH) = PK ---> es aquel valor del PH en el que el ácido o base débil está la mitad disociada y en otra mitad sin disociar.
COOH = COO + H+ PK= [6,8]---> Es el valor que indica que la mitad está ionizada y la otra mitad sin ionizar.
En este caso sin ionizarse por debajo de 6,8 y ionizado por encima de 6,8.
Las bases de Nitrógeno son las únicas que capturan H+.
NH2 + N+ ------> NH3+ PK = 9 |5|
Cuando el PH está por encima ----> ___ carga
Cuando el PH está por debajo ----> ____ carga
Cuando el PH está por igual ----> mitad – mitad
Forma de las proteínas
Dependen de sus cargas eléctricas durante el metabolismo.---> H+ /- OH más o menos PH.
Es esencial que no cambie el PH ya que sino cambian las cargas eléctricas , cambia la forma y cambian la función (de la proteína ) y eso no puede ser (PH Aprox. 7)
Entonces se necesitan los sistemas amortiguadores. Con las cargas eléctricas se utiliza el sistema tampón.
Los seres vivos sólo aguantamos entre 6,7 y 7,3 de PH.¿cómo aumentamos esta neutralidad? Con los sistemas tampón ---> Homeóstasis.(manutención del PH)
- SALES MINERALES
Una sal es la unión de un ácido y una base .
SAL + AGUA ---> SE DISUELVE
Cl Na -----> Cl - + Na (iónico)
se aíslan las cargas que rompen el enlace y se disuelven.
Tenemos por ejemplo:
Aniones de Cl- ,H2CO3, -HPO4 , =HPO4 ----> Como están disueltas nosotros no
Cationes de Na+ , K+ Mg++ Ca+ -------------> tenemos sales , sólo aniones cation-
es y disolución.
Algunas sales producen funciones específicas.
- El fosfatocálcico --->dientes y huesos.
- El Cl+ /Na+/K+--->contracción muscular, impulso nervioso.
- Mg++/Ca++----> cofactores enzimáticos.
Pero todas las sales cumplen unas funciones generales por su naturaleza o propiedades químicas.
¿Cuáles son?
1Regulación de los equilibrios químicos /osmóticos.
La presión osmótica es directamente proporcional a la concentración de soluto.
Se necesita igualar la presión osmótica para que no se produzca el choque osmótico. Por ello el medio debe ser isotónico.(| |=| |).Entonces ,para ello,necesitamos el agua.
Las sales solubles crean la presión osmótica (sed de agua o de sal)
Se utilizan para contrarrestar los cambios de presión osmótica que se producen continuamente durante el metabolismo.---->Función general de las sales.
2Regulación de los equilibrios ácido /bases.
El PH debe ser neutro para mantener las cargas eléctricas de la proteína para que conserven su forma y su función.
(La estructura y forma es distinta. La forma depende de la estructura.)
Continuamente en metabolismo:
H+ (bajo PH) -OH(alto PH)
Gracias a los sistemas tampones, mantenemos el PH neutro ya que los tampones capturan las cargas eléctricas desde que se forman. PH constante.
Un tampon está formado por : Ácido / Base (débil) + sal
La mayoría de los cambios van hacia la acidez así que hacen falta más sistemas tampón para los ácidos. Ha dos tipos de tampones:
- Los que captan carga +
- Los que captan cargas - (base /acidez)
Ejemplo de tampón para ácido:
H2CO3 /Na HCO3 = 1/20 -----> Hay un ácido carbónico por cada carbonato cálcico.
ClH----> Cl- + H+ bajo PH, pero --->Na HCO3 ---> Na+ + HCO3
ClH + HCO3 ---> ClNa + H2CO3 ….y así no ha variado el PH pero ¿está en la proporción 1/20?
Sí, ya que el ClNa se elimina mediante la orina y el Co2 + H20 se elimina en el aire.
PO4H3 / PO4HCa ---> también es un tampón.
Las proteínas también actúan como tampón ya que poseen ácidos /bases.
3Regulación de equilibrios eléctricos.
Las sales son iones. Tienen cargas eléctricas por lo que son responsables del establecimiento y mantenimiento de proceso eléctricos como los que caracterizan los típicos de músculos y neuronas.
- GLÚCIDOS
Concepto y clasificación.
Se les conoce como carbohidratos C(H2O)
La fórmula general de los glúcidos sencillos es : Cn (H2O)n
Se descubrieron distintos tipos de grupos funcionales dentro de los glúcidos y que no coincidían con esa fórmula general y es por eso por lo que no coincidían con esa fórmula general y es por lo que no se les conoce como carbohidratos.
Los glúcidos que vamos a ver son polímeros de monómeros iguales: glu+glu+glu.
Funciones de los glúcidos.
- Reserva energética (almacenan glucosa)
- Estructural(actúan como ladrillos que se repiten)
Clasificación:
- osas--->monosacáridos.
- ósidos--->más de un monosacárido
- Holósidos: sólo monosacáridos.
- Oligosacáridos(2-10 monos.)
- Polisacáridos(+ de 10 monos.)
- Homopolisacáridos(mismo monómero)
- Heteropolisacárido(distintos monosacáridos)
- Heterósidos:formados por monosacáridos + otras moléculas no glúcidos)
- Glucoproteínas.
- Glucolípidos.
Nosotros estudiaremos los holósidos.
Monosacáridos:estructuras y funciones.
Son los más sencillos. Se pueden romper pero si lo haces ya no sería un glúcido. Es el monómero de el resto de los glúcidos.
Son glúcidos formados por 3-9 carbonos. Los más frecuentes son entre 3-6 carbonos.
Los monosacáridos se definen químicamente como polihidroxialdehído o polihidroxicetona.
Están formados por un esqueleto de hidrocarburos o carbohidruros. (CH2 o CH). Son apolares, enlaces covalentes.
Grupo hidroxilo o alcohol.
Todos los carbonos excepto 1 tienen un alcohol. Son grupos polares
H-C=O
|
H-C-OH ----->aldotriosa + grupo carbonilo (=O)
|
H-C-OH
- El grupo carbonilo
- C. terminal aldehído -------> grupos polares.
- C. interior cetona -------->
La aldosa y la cetosa siempre van a estar en el carbono 1.
Propiedades físicas.
El monosacárido se dice que es: dulce, blanco ,cristalizables y solubles (+polares, +cortos)
Nomenclatura.
Grupo carbonilo + nº de carbonos + osas...(aldo o ceto) + 3(tri)osas
1Propiedades de los monosacáridos
- Isomería espacial e isomería óptica.¿Qué son isómeros?Dos sustancias que tiene la misma fórmula molecular pero distintas propiedades físicas o químicas.Misma fórmula molecular y distinta geometría, posición, forma espacial, etc.
Entonces una isomería espacial es un monosacárido con la misma fórmula y distinta estructura espacial(estereoisómeros)
Cuando no hay ni centro, ni eje, ni plano de simetría , presenta isomería espacial: dos formas en el espacio.(como por ejemplo las manos.)
Además de isomería espacial también presentan actividad óptica o isomería óptica. Isomería óptica es aquellos que tienen igual fórmula molecular y distinta actividad óptica.
La luz vibra en todas direcciones del espacio pero existen los polizadores (quita reflejos). El polarizador es un mineral que por su estructura reflejan todas las luces excepto las que vibran en un sólo plano ya qie es el que les permite su estructura.
La luz polarizadora atraviesa por una disoluciónde monosacáridos que está desviada respecto con la que entró.
- Luz hacia la derecha---> + dextrorrotatorio.
- Luz hacia la izquierda--->- levorrotatorio.
La única forma de saber si es dextrorrotatorio o levorootatorio es haciendo el experimento.
Cuando hay dos isómeros espaciales se superponen uno entre otros.(como una imagen en el espejo --->enantómeros)
¿Por qué tienen estas propiedades?
Porque no tienen ni centro , ni eje, ni plano de simetría y tienen estensiometría porque tienen carbonos asimétricos.
C
|
A-- C – B ---> esto es ser asimétrico (4 sustituyentes distintos)
|
D
Monosacárido más sencillo:
H-- C =O -------->Aldotriosa o D-gliceraldehído. Por cada C. simétrico tiene dos
| estereoisómeros. Según donde esté el OH puede ser o D-.. o
H-- C-- OH L-...
|
CH2OH
CH2OH ------------>Dihidroxicetona o cetrotriosa. La mayoría de los monosacá
| ridos que existen en la naturaleza son: D-...
C=O La cetotriosa no tiene ni D ni L ya que es el único que no
| presenta ismería espacial.
CH2OH
- 1.2 Forma de los monosacáridos.
Cuando hay más de un carbono asimétrico se decide cuál es según esté más lejos del carbono carbonilo , osea , el más alejado del carbono 1.
H-C=O
|
H-C-OH
|
OH-C-H --------->Glucosa.
|
H- C-OH
|
H- C -OH ----->en este caso sería D-glucosa.
|
CH2OH
Aquellos carbonos formados por más de 5 carbonos NO presentan una forma lineal y plana. Sino ciclados y tridimensionales. La forma lineal y plana es la menos frecuente.
H-C1=O --|
| |
H-C2-OH |
| |
OH-C3-H |
| O ----->enlace M-acetal. Unión de el carbono carbonilo
H-C4-OH | con el carbono 4 o 5 en hexoxas.
| |
H-C5-OH ---|
|
CH2OH
5 eslabones (furanosa) 6 eslabones.(piranosa)
Formando un enlace entre el carbono carbonílico y el C 4 ó 5 y se forma un enlace nuevo hemiacetárico , en realidad, este enlace es una reordenación de átomos entre el carbono 4 y el carbono 5 y se quedaría así:
OH
|
H-C=O ---
| |
H-C-OH |
| O
OH-C-H | ------> ¿Cómo se pasa?Mediante las reglas HAWORTH
| | 1º regla:dice que lo que está a la derecha se queda hacia abajo
H-C-OH--- y viceversa(excepto en el C4 y C5)
| 2º regla:trazo grueso para los que están delante y viceversa.
CH2OH
D-Glucosa D-Galactosa D-fructosa
M-acetal (enlace) forma anillos.
¿Por qué les gusta estar ciclados?
Porque el grupo carbonilo es muy relativo y al cerrarlo no reaccna fácilmente con otras cosas.
Por convenio no se ponen ni los H ni los C,ni OH ,se indica sólo el C6. En la forma ciclada se vuelve asimétrico pero se denomina anomérico(nuevo asimétrico) : hemiacetálico carbonilo y cuando el OH del carbono anomérico está arriba se llama Beta o Alfa cuando está abajo.
En la glucosa el 63% es forma Beta y el 36% forma D y del 1-5 % forma lineal.
D-fructosa Alfa D-fructosa
Ribosa Dexoxirribosa
- 1.3. Poder reductor de los monosacárdos.
Quiere decir que es capaz de reducir a otras sustancias, es capaz de ceder electrones, oxidándose. Esto ocurre porque el carbono carbonilo reduce a alguno convirtiéndose en COOH (ácido).
(medio básico)
CuO(óxido cúprico azul) C=O -----------------> Cu2O(cuproso rojo) C=O (ácido)
| |
H OH
Detección de monosacáridos en disolución (orina/diabetes).Si el azúcar no es absorbido se elimina mediante la orina)
2Monosacáridos de importancia biológica.
-Monosacáridos con 3 carbonos: gliceraldehído(aldotriosa) o dihidroxicetona(cetotriosa)
El aldehído o la cetona aparecen dentro de la glucolisis + fase oscura de la fotosíntesis = vías centrales del metabolismo.
-Monosacáridos con 5 carbonos: ribosa (ARN) y dexoxirribosa(ADN, carbono2 sin O)(aldopentosas)
Cetopentosa-->ribulosa (se une con el CO2 en la fase oscura de la fotosíntesis)
Ribulosa + Co2 +[6C]+ 23 C ---->(la enzima que actúa en esta reacción es la encima que más se encuentra en la naturaleza.)
-Monosacáridos con 6 carbonos: D-glucosa y D-galactosa (epímero en 4 de D-Glucosa)
Epímero:se produce cuando
se diferencian en un átomo. P.E: Glucosa (OH del C4 a la derecha) y Galactosa (OH del C4 a la izquierda)
3Función:
Aldohexosa
cetohexosa -----> fuentes de energía (combustible en la respiración celular) y
D-fructosa también actúan como monómero de sus polímeros.
Oligosacáridos: concepto y clasificación
Son aquellos glúcidos formados de 2-10 monosacáridos. Nosotros sólo hablaremos de los disacáridos.
Unión / enlace entre monosacáridos (disacáridos)
Se une mediante el enlace glucosídico. Este se establece entre un OH de 1 carbono carbonilo y un OH de otro carbono que puede ser carbonilo o no.
Si en el enlace intervienen 1 enlace carbonílico, se denomina enlace monocarbonílico y si ocurre con un enlace de OH dos grupos carbonílicos se denomina dicarbonílico.
OH + OH ---->-O- -------> + H2O (hidrólisis,romper enlaces con agua)
Al unirse se desprende el agua pero esta también sirve para romper el enlace.
Tipos de disacáridos
Lactosa(galactosa+glucosa, enlace beta 1-4), sacarosa, maltosa, y celoviosa.(los que hay que saber)
Siempre se indican los numeros de los carbonos que intervienen.(1-4)[C1=carbonilíco, C4=carbonílico o no,]
-Lactosa [nombre comercial: Beta -D-Galactopiranosil(C1 carbonilo)(1-4)Alfa o Beta -D-Glucopiranosa(C4 no carbonílico)
Aún que Juan lo nombra Beta galactosa 1-4 glucosa.
-Lactosa(galactosa y glucosa)
Alfa -D-Galactopiranosil(1-4)Beta D-glucopiranosa.
-Sacarosa(glucosa+fructosa)(dicarbonílico)
Alfa D-glucopiranosil(carbonílico)(1-2)Beta-fructofuranósido(también es carbonílico).
O como diría Juan Alfa glucosa(1-2)fructosa.
-Maltosa.(2Glucosa)Alfa (1-4)Alfa glucosil (1-4)Alfa D-glucósido.
-Celobiosa.2Glucosa Beta (1-4)
Los disacáridos naturales son la sacarosa y la lactosa. No están en la naturaleza ninguna maltosa ni celulosa pero por hidrólisis del almidón da la maltosa y la hidrólisis de la celulosa da la celoviosa.
-Los disacáridos reductores son la maltosa celulosa y lactosa(monocarbonílicos.).
-Los disacáridos no reductores son la sacarosa(dicarbonílico)
Función
Actúan como combustible de la respiración celular.
Polisacáridos
Son aquellos con más de 10 monosacáridos. No son ni dulces, ni cristalizables, ni soluble (debido a su gran tamaño). No tienen poder reductor(debido a que los carbonos están ocupados por los enlaces)
-Holósidos (sólo monosacáridos)
-Heterósidos(monosacáridos+otras moléculas)
Holósidos:
- Homopolisacáridos(sólo un monosacárido)
- Heteropolisacáridos(distintos monos)
Holósidos--->homopolisacáridos.
n(C6H2O6)--->(C6H10O5)---(n-1)--->H20(porque el primero y el último no forman el enlace.
1Almidón
Es el polisacárido de reserva vegetal. Amiloplatos--->Amilo(contiene almidón)plastos(célula vegetal[cloroplastos]
Es una buena forma de almacenar glucosa porque es insoluble y al no disolverse no produce presión osmótica.
En realidad el almidón son 2 tipos de cadenas de glucosa:
1ºcadena-->amilosa(20%)
2ºcadena--->amilopeptina(80%)
Amilosa--->glucosas con enlace(1-4)dando lugar a:
Es lineal y helicoidal.
Amilopectina--->glucosa con enlace Alfa(1-4) pero de tramo a tramo da lugar una rama lateral de 25 glucosas(1-4)
¿Cómo se rompe el almidón?Por hidrólisis de la maltosa(2glucosa 1-4)
2Glucógeno
Es el polisacárido de reserva animal(mucho menos importante que el almidón para las plantas ya que nuestra reserva es la grasa).
Los encontramos en órganos con alto consumo energético(corazón, hígado, músculos).
Glucosa Alfa(1-4)--->sólo un tipo de cadena aproximadamente amilopectina sólo que son más largas y más ramificadas.
3Celulosa
Es un polisacárido estructural. Forma la pared celular de las células de los vegetales.(exclusivo de vegetales)
Por hidrólisis de la celulosa aparece la celoviosa que es un 2glucosa Beta(1-4)
Cuando el enlace es Beta(1-4) forma la misma cadena helicoidal (como una antena de teléfono). La hélice es tan apretada que protege a los enlaces glucosídicos que los protege y los vuelve inaccesibles, es decir, los vuelve muy difícil de hidrolizar. Se puede decir que la celulosa es inerte ya que no se puede acceder a ellos desde fuera. Por eso son un buen material de construcción (estructural). Si a esto le añadimos que es insoluble---->mejor material estructural. Si además de esto forma haces, actúan como una malla. Son paralelas en cada capa y cruzadas con la anterior y posterior. Esto es igual a una estructura cuasicristalina.
½ carbono orgánico es celulosa(bacterias protozoos y termitas). Para el resto de los organismos la celulosa no se digieren. No se digiere pero es buena para la dieta ya que facilita la movilidad intestinal contra el estreñimiento. Esto también sirve para prevenir el cáncer de colon. (FIBRA VEGETAL)--->celulosa.
4Quitina
Forma el exoesqueleto en artrópodos y pared celular de los hongos. Es el polímero no ramificado de la N-acetilglucosamina con enlaces Beta 1-4
- LÍPIDOS
Concepto y clasificación
Los glúcidos, las proteínas y los ácidos nucleicos son químicamente homogéneas pero pero los LÍPIDOS SON HETEROGÉNEOS. Por eso no existe fórmula general para los lípidos ,entonces, se les agrupa por sus propiedades o por sus funciones, que son comunes.
Características
-Son muy apolares (reducidos en muchos electrones y mucha energía).Como conclusión de esto, algunos actúan como reserva de energía.
-Son hidrófobos, insolubles en agua.
-Son lipófilos, se disuelven en otros lípidos, disolventes orgánicos(aguarrás, el alcohol, la gasolina, el cloroformo , el éter,etc.)
-Actúan como aislante estructural.
Clasificación
-Lípidos saponificables o derivados de ácidos grasos
- lípidos sencillos
- acilglicéridos
- ceras
- lípidos complejos
- glicerolípidos
- esfingolípidos
-Lípidos no saponificables o derivados de isopreno
- terpenos
- esteroides
1Lípidos saponificables
1.1Lípidos sencillos:
Todos están formados por un alcohol y por un ácido graso.
- Acilglicéridos/grasas y ceras.(acil-->ác.graso,glicérido-->glicerina)acilglicéridos=glicerina + ácidos grasos
[ácidos grasos]
Lo más característico de los saponificables. Son cadenas pares de hidrocarburos saturados o insaturados y además un grupo ácido.
-Hidrocarburos--> CH-CH2-CH3--->son apolares.
- Saturados(enlaces sencillos)
- Insaturados(dobles o triples enlaces)
-Ácidos (-C=O --->-COOH) <---> Coo- H+ --->son polares.
|
OH
Fórmula general: CH3(CH2)2n -COOH
Ácido más sencillo:
Ác. Fórmico --->H-COOH(ácido de las hormigas)
Ác. Acético --->CH3-COOH
Palmítico ----->CH3-(CH2)14-COOH
Oléico ---->CH3-(CH2)7-CH=CH-(CH2)7-COOH
Esteárico ---->CH3-(CH2)16-COOH
Características:
Son bipolares (parte polar y parte apolar-->anfipáticos)
Los números de Carbonos saturados/insaturados determinan sus:
Propiedades y Funciones.
(estructura)
- Los saturados(cadenas sencillas)
- Los insaturados
En la imagen de la derecha el saturado ,en la izquierda el insaturado.
En la imagen de la derecha , se forma un codo y se rompe la estructura zigzagueante. Por el hecho de la existencia de un codo presenta isomería geométrica(de posición -->misma fórmula y distinta geometría)
- WW A B WW A H\ / \ /C=C C=O
/ \ / \
H H H B
CIS TRANS
Dos posiciones distintas :CIS O TRANS.
O O
|| ||
C=C ----> n C-C
Los dobles enlaces pueden convertirse en aldehídos o cetona y entonces se racian(mal sabor de enraciamiento).
Saturados:
Se caracterizan por alto punto de fusión (tocino,manteca)
¿Por qué?Si se juntan se encajan unos en otros.
/\/\/\/\/\/\/\/\/\/\/\/\
Hay muchos enlaces covalentes MUY próximos. Esto quiere decir que hay muchos electrones compartidos (esto también ocurre en los anillos) y esto hace que halla muchos electrones libres que saltan de un enlace a otro apareciendo Cargas Eléctricas Fluctuantes-->aparecen y desaparecen.
Se forman enlaces electromagnéticos con cargas eléctricas que se denominan enlaces por fuerzas de VAN DER WALLS.
Insaturados:
Se caracterizan por el punto de fusión bajo que hace que sea líquido.
O
/\/\_/ \/\_/\
\/\O/\/\/\/\/\ --->Entre ellos tiene menos enlaces debido a los codos y menos
O_ uniones por lo que no tienen fuerza de VAN DER WALLS
/\/\/\/\/ \ bajo punto de fusión)
Los ácidos grasos cortos tienen un punto de fusión más bajo(no tiene fuerza de VAN DER WALLS)
- AcilglicéridosEsterificación de ác. Grasos con grupo alcohólico glicerina.
1 ác.graso ---> monoglicérido.
2 ác.graso --->diglicérido.
3.ác.graso --->triglicérido.
Una grasa es más apolar que la glicerina y los ácidos grasos de los que están formados. Con la esterificación se pierden los escasos grupos polares que habían.
GLICERINA+ÁCIDO GRASO MÁS POLAR QUE GRASA.
El éster se rompe por hidrólisis. La grasa es como una sal(base+ácido)
-el alcohol actúa como base. ------> más o menos
-el ácido graso actúa como ácido. ------> sal.
Entonces con la sal hacemos lo mismo que con la hidrólisis:
A este proceso se le denomina SAPONIFICACIÓN.
Función de las grasas:
Su función es de reserva energética animal porque almacenan ácidos grasos (combustible de la respiración celular).
-Los ácidos grasos tienen más H+ --->más reducidos--->más energía.
-Los monosacáridos, sin embargo, tiene más O- --->oxidación--->menos energía
Un gramo de grasa tiene 6 veces más energía que un gramo de glucógeno. Por esto lo animales pesamos la mitad de lo que pesaríamos si tuviéramos glucógeno. Esto implica más movilidad.
-Como los ácidos grasos son insolubles, se guardan fácilmente en la célula. Esas gotas de grasas son inclusiones de la célula.
En una célula vegetal se guardan los polisacáridos en los amiloplastos para que no se mezclen con agua.
-Actúan como aislante térmico.
- CerasSon los ésteres de un ácido graso largo y saturado(normalmente parmítico/esteárico con un alcohol monovalente de cadena larga.CH3-(CH2)n-CH2-OH
Son lípidos sencillos.
Al ser apolar, son impermeables(agua/gases)
Es muy saturada y larga por lo que tiene un alto punto de fusión y se encuentran en estado sólido.
Función
Impermeabilizante/estructural/protectora.
Como, por ejemplo, el cerumen de los mamíferos, la epidermis vegetal en las abejas, en las glándulas oropignianas en las aves.
1.2Lípidos complejos
-Glicerolípidos y esfingolípidos.
- Glicerolípidos
Mediante hidrólisis se rompe el éster que da lugar a la glicerinay 2 ácidos grasos. Algunos tienen además:
-bases nitrogenadas(Aa colina)=glicerofosfolípidos (fosfolípidos)
-monosacáridos=gliceroglucolípidos(exclusivos de membranas bacterias)
fosfolipasas gliceroglucolípidos
Los lípidos son anfipáticos, es decir, su cabeza es polar y su cuerpo apolar. El cuerpo esta formado por glicerina y dos ácidos grasos y la cabeza es lo demás. Y esto hace que se crea micelas.
Las bicapas de fodfolípidos forman el esqueleto de las membranas celulares. Es el principal lípido.
- Esfingolípidos
-Viene dada por la EFIGUE DE TEBAS.(te come el coco si no averiguas el secreto)
-Son anfipáticos.
Están formados por un alcohol llamado ESFINGOSINA(aminoalcohol de cadena larga)
N
/\/\/\/\/\/\/\/\OH
Esterificado con un ácido graso
-->cerámido
--->ácido ortofosfórico+base nitrogenada=esfingofosfolípido
--->hexosa o oligosacárido=esfingoglucolípidos
Los esfingolípidos también son componentes de la membrana pero ESPECIALIZADOS
--->antígeno A/B o grupos sanguíneos.
--->anclajes para los virus y las toxinas.
--->forman las vainas de mielina
--->control de la división y diferenciación celular. La división es inversamente proporcional a los esfingolípidos y viceversa. Si están juntas se diferencian y si están separadas se dividen.
Una célula cancerosa se divide contínuamente sin control (el control es el esfingolípido)-->las células sólo se diferencian.
2Lípidos no saponificables o derivados del isopreno.
Se dividen en Terpenos y Esteroides
No tiene ni ácidos grasos ni enlaces éster.
Fórmula general:2metil-1,3 butadieno.
CH2=C-CH=CH2
|
CH3
2.1Terpenos
Derivados directamente del isopreno.
2 isoprenos-->1terpeno. Podemos encontrar monoterpeno, diterpeno, y trterpeno.
Concepto
Se define como un polímero lineal de terpenos ciclados en los extremos.
Como tienen muchos dobles enlaces esto da lugar a las:
Propiedades y funciones
P- Todas tienen color debido a los dobles enlaces.
---->carotenos(rojo-anaranjado)tomates,zanahorias,naranjas(precursores de la vitamina A,E y K.
---->xantofilas(amarillas).
---->fitol(verde)forma parte de la clorofila.
F- Biológica(muchos dobles enlaces) y esto implica electrones compartido,electrones libres-->electrones delocalizados --->muy excitables--->capaces de absorber energía y actúan como pigmentos fotosintéticos.
A través de la clorofila cogen la energía electromagnética y el electrón pasa de un nivel a otro nivel superior-->energía química.
Por esto mismo los terpenos ceden y aceptan fácilmente electrones con lo cual forman parte de las cadenas transportadoras de electrones (fotosíntesis+respiración celular)--->las coenzimas Q/plastoquinona.
Son terpenos:
-Las resinas(jara y romero)-->terpenos
Tienen la característica que reflejan la luz y enfría la planta cuando se evapora lo que produce un microclima.
-El látex(caucho)---->terpeno
-Esencia vegetales(limón,vainilla,canela,anís,tomillo y mentón)-->terpenos
1.2Esteroides
Son derivados indirectamente del isopreno.
Concepto
Se define como el polímero del esterano. Se diferencian en que tengas OH, dobles enlaces o cadenas de hidrocarburos.
Cuando el esterano lleva un OH es el colesterol.
El colesterol es uno de los lípidos que forman la membrana plasmática.
Actúan como precursor de las hormonas sexuales y la vitamina D.
Forman parte de los ácidos biliares como emulsionantes de los lípidos de la digestión.
Esteroide
Con el OH es el colesterol y lo hace apolar ,uniéndose a las cabezas de los fosfolípidos.
Se une a las cabezas dejando libres las colas , esto inmobiliza a los fosfolípidos. Impide la bicapa convirtiéndola en monocapa . Le aporta a los lípidos de las membranas insaturación haciendo que suba el punto de fusión y a su vez haciendo que sean más líquidos. También aporta fluidez a la membrana(si es sólida no existe intercambio)
Las células tienen unos receptores que recogen el colesterol. Cuando hay mucho colesterol, ocupan los receptores y se unen indeseablemente a las cabezas de los fosfolípidos pero por fuera. Si esto ocurre en un vaso sanguíneo , puede llegar a destruirlo y dar lugar a la trombosis.
- Proteínas
Concepto e importancia biológica
Etimologicamente, deriva de dos palabras griegas:
Proteos---->dios que cambiaba de forma(infinitas formas que poseen las proteínas.
proteios--->el primero(las proteínas son cuantitativamente las moléculas más abundantes de los seres vivos.(el 50% en peso seco de los seres vivos)
Funciones
-catalizadores(enzimas)
-reguladores(músculos)
-responsables del movimiento(músculos)
-estructural(pelo)
-protección defensiva(anticuerpo)
-transporte(hemoglobina)
Mientras que los glúcidos y los lípidos son pasivos e inertes, las proteínas tienen actividad biológica.
Son polímeros de monómeros distintos-->aminoácidos(Aa). Las proteínas están formados por monómeros distintos.
Concepto
Las proteínas son secuencias de Aa, determina la forma de la proteína. Los polímeros los podemos definir como polímeros lineales de aminoácidos.
Son macromoléculas de PM=1014 - 106
Son moléculas complejas que se montan y se desmontan con facilidad---> una de las funciones que esto implica es la renovación constante de la materia viva.
Se le hace la hidrólisis a una proteína subiéndole la temperatura o bajándole el PH.
Polipéptidos--->se rompen en cadenas más pequeñas que son los péptidos.
Aminoácidos
Los aminoácidos son los monómeros de las proteínas. Todos tienen en común esta parte de la molécula.
Ese carbono central es el carbono Alfa y está rodeado de un amino, un ácidos, un hidrógeno y un radical o resto.
Propiedades de los aminoácidos.
-Carácter ácido/básico.
Esto quiere decir que se comportan como ácidos a PH básicos y como base a PH ácido.
Curva de titulación de un aminoácido : alanina
PK--->el valor de PH en el que la mitad están disociados y la mitad sin disociar.
Si cambia el PH cambia las cargas eléctricas de los aminoácidos.
-Son polares--->porque tiene un grupo amino y un grupo ácido --->son solubles en agua -->son cristalizables-->tienen un alto punto de fusión (como el agua) -->líquido a sólido fácilmente.
-Isomería espacial y óptica(por los carbono asimétricos)
El carbono Alfa es un carbono asimétrico (cuatro sustituyentes distintos)
COOH
|
H - C -NH2 Si en los monosacáridos nos fijábamos en el grupo OH, en
| los aminoácidos nos fijamos en los grupos aminos.
R D-aminoácidos
L-aminoácidoa(abundan más)
Iomeróa óptica-->desvía la luz polarizada(destrojio,levojilo)
solamente hay un aminoácido que no presenta isomería espacial:
GLICOLA
COOH
|
NH2- C -H
|
H ---->no presenta ni isomería espacial ni óptica.
Clasificación de lo aminoácidos
Se clasifican según su resto a PH7 y esto priduce 3 columnas:
Aa apolares Polar sin carga Polar con carga - Polar con carga +
-Prolina(grupo amino -Cisteína(azufre) -ácidos aspártico -lisina
ciclado) -ácido glutámico -Argina
-Fenilalanina -Histidina
-Tristófano
-Tirosina
Enlace peptídico
Es el enlace que une a los aminoácidosSe establece entre un ácido y un amino dando lugar a:
El primer aminoácido de la cadena tiene el amino libre y el último de la cadena tiene el grupo ácido libre. Los átomos petídicos tienen que estar necesariamente en el mismo plano.
H
|
-C-N- Esto tiene que ser así porque es un enlace resonante, un cierto carácter
|| sencillo y uno doble. Al estar en el mismo plano, no pueden girar
O excepto los otros átomos. Se encuentran en el mismo plano para poder compartirse electrones entre ellos.
-C=N-
| --->enlace doble
OH
El giro que más influencia tiene es el del carbono Alfa que al girar arrastra el resto y determina la forma de la proteína.
El enlace peptídico es un enlace resonante.
O OH
|| |
-C-N- -C = N-
|
H
Deben compartir electrones que les hace estar en el mismo plano. No pueden girar, los demás sí, especialmente importante el giro Alfa (arrastrar)que determina las estructuras de las proteínas.
Al formarse enlaces peptídicos, se produce una ñínea quebrada de los átomos peptídicos y de los carbones Alfa en el que los restosquedan alternativamente hacia arriba y abajo haciendo una línea quebrada.
Estructura de las proteínas
Aminoácido con enlace peptídico. Dipeptídico(2-10), polipeptídico(+ de 10 Aa). Una proteína está formada por 1 o más polipéptidos.
Estructura primaria
Cada proteína formada por ciertos aminoácidos en un determinado orden: secuencia de aminoácidos. Esta secuencia de Aa es caraterística de cada proteína, es específica de cada proteína. Esta sería su estructura primaria. Línea quebrada por átomos peptídicos y los carbonos Alfa en la que los restos se alterna hacia arriba y hacia abajo.
La estructura primaria determina el resto de estructuras (y su función) y sus propiedades. Como por ejemplo la especifidad de especies.
Especifidad de especies: una msima proteína determina las diferentes estructuras en las distintas especies.
La hemoglobina humana no tiene la misma función que la hemoglobina de vaca, por ejemplo.
Los aminoácidos esenciales son esenciales para la función o para la estructura de la proteína , no varían a lo largo de la evolución.
El resto de los aminoácidos son los que varían de una especie a otra.
En conclusión desde el punto de vista de la estructura, la estructura en la proteína es extendida. Cuando se conoció la primera estructura, se supuso que como era extendida todas las proteínas eran extendidas, osea , no presentaba más estructuras.
Disfracción de Rayos X.
Presentan una forma tridimensional, una forma espacial que es lo que se llama ESTADO NATIVO(forma de la proteína). Es el estado que presenta más enlaces ,más estable,con menos energía libre. Este estado es el resultado de varios niveles estructurales y todos dependientes de la estructura primaria. Así, todas las proteínas presentan también una estructura secundaria.
Estructura secundaria
Primera estructura secundaria:
Todas las estructuras secundarias son el resultado del giro de carbono Alfa Hélice. La estructura Alfa Hélice se forma al girar los carbonos Alfa en hélice alrededor de un eje imaginario. Este giro es de 3,6 aminoácidos por vuelta.
Esto pasa porque el aminoácido que está en el carbono 1queda enfrentado con el aminoácido 5 quedando enfrentados en posición geométrica correcta.(distancia y orientación correcta para formar puentes de hidrógeno)
O H
1 \ || /\ | 5
C N
Puentes de hidrógeno intracatenario.(dentro de la cadena)
Estos puentes de hidrógeno son los que mantienen el Alfa Hélice. Siempre es 3,6 porque cada 4 aminoácidos crea puentes de hidrógeno (más enlaces) y , por tanto, más largo. Los restos quedan hacia fuera de la hélice.
Segunda estructura secundaria:
Otro tipo de estructura secundaria. Carbono Alfa actúa como punto de plegamiento. Los puentes de hidrógeno también se producen aquí pero son intercatenarios(entre cadenas)
Tercera estructura secundaria:
Triple hélice colágeno. También forma hélice sólo que el colágeno en la estructura primaria del colágeno abundan la prolina y la hidroxiprolina (son aminoácidos con grupo amino ácido, carece de hidrógeno para formar puentes de hidrógeno)
No se forman puentes de hidrógeno intracatenarios y se forma una hélice extendida con puentes intercatenarios (como una cuerda de tres cabos)
Estrutura secundaria NO pura:
No están ni completamente estructurada ni de un sólo tipo.
Por ejemplo:
Alfa Hélice +discontinuidades(no tiene estructura secundaria)+Beta Hoja plegada.
Este conjunto de estructura secundaria y de su discontinuidades constituyen el estado nativo, es decir, la estructura terciaria.
Estructura terciaria
Conjunto de estructura secundarias y discontinuidades(rotura de estructura secundaria)
Las causas de las discontinuidades --->prolina e hidroxiprolina que rompen la estructura secundaria porque no forman puentes de hidrógeno (amino ciclado)
Lo mismo ocurre con los aminoácidos que tienen restos apolares hidrófobos(huyen del agua) que se introducen dentro de la estructura secundaria (huyen del agua, buscan un ambiente lipófilo del interior). Producen discontinuidad en la estructura secundaria especialmente si además son voluminosas--->fenilalanina y trstófano.
También produce discontinuidad aminoácidos cercanos con cargas iguales o distintas.
Las cargas distintas se unen y las cargas iguales se repelan-->discontinuidad. Esto hace que se rompa la estructura secundaria.
La Cisteína tiene un grupo SH. Si dos Cysteinas se encuentran enfrentadas en la posición geométrica correcta, se forma un puente de disulfuro entre ella que provoca discontinuidad y que también rompen la estructura secundaria.
SH----SH
| |
Cys Cys
Si sólo tiene estructura terciaria, este es su estado nativo.
Si imaginamos una estructura terciaria en la que hay zonas en las que la parte de la estructura secundaria se une con otra estructura secundaria (enlaces nuevos)
La estructura terciaria se mantiene gracias a unos enlaces nuevos resultantes de la forma de la proteína. Encontramos distintos enlaces:
Interacciones eléctricas entre cargas permanentes.
- Aminoácidos con cargas distintas llamadas interacciones crónicas[aminoácidos ácido con base (carga positiva y carga negativa)]
- Puentes de hidrógeno H/O/N átomos electronegativos cargados.
- Fuerzas de VAN DER WALLS (atracciones eléctricas entre cargas fluctuantes)Se producían entre hidrocarburos, anillos muchos dobles enlaces comparten muchos electrones--->muchos electrones libres--->cargas fluctuantes
- Interacciones hidrofóbicas:Los restos apolares se introducen hacia dentro de la cadena por hidrófobos y se unen entre sí por ser lipófilos.
Todos estos enlaces son débiles pero como son números permiten sostener la estructura terciaria.
Además de los enlaces, hay enlaces fuertes llamados puentes de disulfuro que son enlaces covalentes de cisteínas.
ALGUNAS proteínas presentan estructura cuaternaria, cuando la tienen, este es su estado nativo (su fórmula). Son aquellas proteínas con subunidades, como la hemoglobina.
4subunidades con estructura terciaria:
Estructura cuaternaria
Es la unión de subunidades con estructura terciaria. Los enlaces en la estructura cuaternaria aparecen a unirse la subunidad. En la estructura cuaternaria ocurre lo mismo que en la estructura terciaria(puentes de hidrógeno,etc)excepto con los puentes de disulfuro. Todos estos enlaces son débiles.
Relación entre estructura y función
Los enlaces que mantienen el estado nativo son débiles y se modifican según el ambiente , pero también según la función. La función depende de la estructura que determina que ciertos restos en superficie sean capaces de interaccionar débilmente con un ligando (Encima-Sustrato, Hb-O2, antígenos-anticuerpos..)para unirse a él y otras interacciones para realizar su función.
Los aminoácidos catalíticos (sólo para las enzimas) no tienen que estar necesariamente seguidos en la cadena juntos por la forma de la proteína y en un surco. Este surco en la superficie de la proteína se denomina Centro Activo (donde va a parar el sustrato)
Propiedades de la proteína
-Solubilidad en agua
Son relativamente solubles porque 2/3 aminoácidos que tienen resto son más o menos polares. Las proteínas también tienen un tamaño muy grande--->no disoluciones(disolución y dispersiones)sino dispersiones coloidales,
-Especifidad
La misma proteína es distinta entre distintas especies y también distinta entre individuos. Esto se debe a que en una proteína hay una serie de aminoácidos esenciales catalíticos o de unión -recuerda sólo para enzimas-. Estos aminoácidos esenciales no cambian nunca ni en especies ni en individuos. Cambian las de relleno de 350 aminoácidos--->50 no cambian.
300 combinaciones 20300
Son tantas las combinaciones distintas que lo extraño serían que fueran iguales.
Proteína específica
- de especie
- de individuo
Aminoácidos esenciales
- los de unión
- los de reacción
- los que mantienen el estado nativo
Aminoácidos no esenciales--->todos los demás.
Varían porque caben tantas combinaciones que lo difícil sería que dos proteínas sean iguales.
350 aminoácidos
- 50 son esenciales
- 300 no esenciales
El sistema inmune conoce nuestra estructura primaria de nuestras proteínas, reconoce lo extraño y repuesta inmunitaria.
Respuesta inmunitaria
- infecciones
- rechaza órganos trasplantados
- transfusión sanguínea errónea
Cuando un aminoácido esencial cambia significa que existe una enfermedad que es producida por mutación ,por ejemplo, anemia falciforme. Los glóbulos rojo normales tienen forma de disco dicóncavo. En la anemia fasciforme lo que ocurre es que ocurre un cambio en un aminoácido esencial po uno neutro (ácido glutamínico-->valina). El cambio de la estructura primaria afecta a la estructura secundaria, terciaria y cuaternaria. Como los glóbulos rojos contienen hemoglobina al cambiar la estructura primaria afecta a los glóbulos rojos haciendo que tenga forma de media luna. Esto hace que el oxígeno baje y produce anemia(falta de glóbulos rojos). Esta anemia es parniciosa. Todos los glóbulos rojos van al vazo para ser destruídos y como tienen forma de media luna, todos son destruídos.
Desnaturalización y renaturalización
El estado nativo se adquiere espontáneamente. Depende de la estructura primaria y se mantiene por enlaces débiles. Como se mantiene por enlaces débiles, fácilmente se pierde o se altera.
Si la proteína en su estado terciario aumenta o baja el PH , la temperatura aumenta, se añade detergente sol, se produce la DESNATURALIZACIÓN, pierde forma (estado nativo), su función y sus propiedades.
Cuando están denaturalizados son solubles y esto hace que precipite.
Es soluble porque los restos quedan expuestos y la cadena queda extendida por lo que son apolares y cambia el tamaño (extendido). Al ser apolar y de gran tamaño, es insoluble ya que para ser solubles tiene que ser polar y de pequeño tamaño.
Esta desnaturalización ha sido suave. Si es suave y vuelve a producirse los mismo cambios que antes, es decir, se le se vuelven las mismas condiciones,la proteína recupera su estado nativo. A esto se le denomina RENATURALIZACIÓN REVERSIBLE.
Si en lugar de devolverle las condiciones, los cambio a más, es decir, le echo más sal o el aumento el PH, se pierde la estructura primaria, es decir, se produce hidrólisis------>DESNATURALIZACIÓN NO REVERSIBLE.
Clasificación y funciones de las proteínas
-en cuanto a su composición : haloproteínas(formadas sólo por aminoácidos)
-en cuanto a su forma: tienen forma globular(albúminas y globulinas)
Las albúminas transportan sustancias en sangre y las globulinas hemoglobina.
Tienen forma fribrosa:
-queratina-->cisteína(pelo,uñas,piel,etc.)
-miosina-->forma parte de los músculos
-colágeno--->conjuntivo que hay bajo la piel;da consistencia.
-proteína antiestiramiento-->tejido óseo,cartilaginoso.
- Heteroproteínas(aminoácidos + otras sustancias no proteicas)
Esa sustancia no proteica se le llama grupo protésticos (prótesis-->ayuda).
En las heteroproteínas el grupo protéstico es el que realiza la función y no la propia proteína. La cadena de aminoácido aporta ambiente adecuado para que funciones el grupo protéstico.
La unión entre un grupo protéstico y al proteína es permanente y fuerte y en cuanto a las coenzimas , la unión no es ni fuerte ni permanente.
- Las Glucoproteínas (son glúcidos)
Se encuntran en las membranas donde se producen las señales de indentificación celular.(antígenos y algunos anticuerpos)inmunoglobulinas(mucina-->mocos)
- La fosfoproteína(PO4H3)
-caseína leche.
-ovoalbumina.
- La cromoproteína (proteína con color) anillo tetrapirróico.
El anillo pirróico al temer mucho dobles enlaces, les da color. Son resonantes porque hay muchos electrones compartidos y al tener muchos electrones libres, captan y ceden fácilmente.(cadenas transportadoras de electrones)y además absorben energía(pigmentos fotosintéticos).
clorofila(pigmentos fotosintéticos).
citocromos(cadena transportadora de electrtrones).
Si el metal que se encuentra en los anillos en el hierro-->hemoglobina,si es magnesio--->clorofila.
- Nucleoproteínas(ácidos nucleicos +proteínas)
Los ácidos nucleicos son los grupos protéicos. Los cromosomas y los ribosomas están formados por nucleoproteínas que también constituyen la cromatina.
-en cuanto a su función.
Sería más fácil preguntarse qué no hacen pero vamos a decir precisamente lo que hacen.
-catalizadores-->aceleran las reacciones.(enzimas)
-reguladoras-->modifican la intensidad metabólica(hormonas de insulina y de crecimiento)
-movimiento-->muscular(actina y miosina)
-defensivas-->anticuerpos del sistema inmunitario.
-transporte-->hemoglobina+mioglobina.
-estructural-->pelo,uñas,cilios,flagelos de la membrana.
- ENZIMAS
Son catalizadores biológicos que se encuentran en cada reacción metabólica de una forma específica. Todas los catalizadores aceleran las reacciones. Como hacen esto aumentan la velocidad de las reacciones.
Los seres vivos somos como un mecanismo que funciona madiante reacciones químicas. Para que el mecanismo sea viable, necesitan que las reacciones ocurran en tiempo real.
1.Mecanismo de acción.
Previamente, para conocer el mecanismo de reacción de las enzimas,vamos a estudiar la cinética y energética de las reacciones químicas en general.
Ecuación química -->A+B-->C
En este caso a la izquierda(A+B) encontramos los sutratos que reaccionan oara formar los productos(C)
Las reacciones de metabolismo siempre son reversibles (A+B<--->C).Si una reacción es reversible existe una reacción de equilibrio.
Básicamente, las reacciones químicas consisten en la formación o en las roturas de enlace. Si tu quieres hacer la reacción de este tipo, tenemos que añadirle una energía para que se lleve a cabo. Esta energía puede ser en forma de calor o descagas eléctricas, pero sólo en el laboratorio se puede hacer esto. Lo que ocurre entonces es que reacciones tendrían una velocidad muy baja y serían inútiles para los seres vivos. El aporte de energía se denomina energía de activación.
Energía de activación
Mínima energía necesaria para formar o romper el enlace. También es la mínima energía necesaria para convertir un mol de sustrato en un mol de producto.
Característica
-Entre el sustrato y el producto hay un compuesto intermedio de transición que se llama el complejo activado. Este se caracteriza porque los enlaces están medio formados o medio rotos). Pero además, tienen un nivel energético mayor y más energía libre que el sustrato porque ha absorbido la energía de activación.
-Otra condición sería que se necesita que se encuentren sustratos y colisionar.
A+B-->C aunque no se puede colisionar de cualquier forma, tiene que cumplirse una geometría de la colisión. Las colisiones correctas que desemboquen en la formación de complejo activado del producto. Si la colisión no es correcta, no sirve para formar el producto.
-En conclusión se necesita la energía suficiente y la geometría de la colisión adecuada, entonces se forma el complejo activado o producto. Si falta algunas de las condiciones de vuelve sustrato.
-La facilidad/dificultad de que una reacción se lleve a cabo,depende de la energía de la reacción. La energía de la reacción es la energía de sustrato menos la energía del producto. Cuando sale positiva , la reacción es exotérmica y viceversa. Cuando es negativa la reacción es endotérmica(necesita energía y va lenta).
También depende de la energía de activación. Cuando la energía de activación es baja, no se necesita aportar energía a la reacción. Porque la temperatura ambiental es sificiente, es sufciente la agitación térmica de los sustratos, basta incluso con la luz. Estas reacciones se llaman ESPONTÁNEAS.
Los catalizadores(enzimas)actúan en muy bajas concentraciones y hace que disminuy la energía de activación haciendo las reacciones espontáneas porque toda la energía se invierte para formar o romper enlaces. Ninguna energía se pierde en colisiones incorrectas. Toda la energía se utiliza en la reacción.
Otra característica
Las enzimas al igual que todos los catalizadores se recuperan intactos. No se consumen en la reacción sino que intervienen en la reacción.
Intervienen en la reacción facilitando la geometría, la colisión al unirse a los sustratos y baja la energía de activación , lo que facilita el desarrollo de la reacción y todo esto sin perder o alterar el equilibrio de la reacción.
En resumen,las enzimas actúan en bajas concentraciones,se recuperan intactas,favorecen la geometría de la colisión y bajan energía de activación y el desarrollo reacciona sin alterar el equilibrio.
Característica de catárisis enzimática.
1.Complejo enzima-sustrato y centro activo
La misma cinética de las reacciones químicas sirven para las enzimas pero presentan una peculiaridad que es que se forma un complejo entre la enzima y el sustrato. Es el llamado complejo enzima-sustrato. Es un complejo intermedio inestable que se va a convertir en producto.
Se da una unión en la superficie de la enzima donde el surco llamado Centro Activo que reconoce al sustrato por su forma(forma centro activo y del sustrato son complementarias), por estereo-especifidad---> específico en el espacio, en su forma.
Cuando el sustrato se encuentra en el centro activo por su complementariedad, esto pone en control al sustrato por fuerzas de VAN DER WALLS. Si el sustrato tiene cargas positivas y la enzima cargas negativas, esto produce interacciones iónicas.
Modelo mano-guante.
Los aminoácidos de unión interaccionan débilmente con ciertos grupos químicos del sustrato formando enlaces débiles(igual a la estructura de la proteína) que mantienen unidos Enzima-sustrato. Cuando encajan esto pone en contacto al sustrato con otros aminoácidos que ahora se llaman catalíticos. Estos aminoácidos catalíticos ,mediante interacciones de enlaces débiles forman la unión, debilitan el enlace que rompen después e la reacción (A--->B+C) o exponen grupos químicos del sustrato que se van a enlazar. Estos aminoácidos catalíticos favorecen el desarrollo de la reacción.
Kosland decía que los aminoácidos esenciales eran:
-los aminoácidos de unión
-los aminoácidos catalíticos.
-los aminoácidos que mantienen la forma esencial.
Podemos pensar que estos están seguidos en la cadena pero no necesariamente aparecen juntos en el centro activo por los pliegues de la cadena y por la forma de la proteína.
2Especificidad
La enzima reconoce a su sustrato por su forma(complementaria con la del centro activo) por estéreoespecificidad o especificidad de sustrato total (hasta isómeros). La enzima no suele reconocer a su sustrato, sino a ciertos grupos químicos del sustrato(especificidad de grupo).
Los aminoácidos de unión también determinan la especificidad de sustrato.
Otra especificidad de sustrato es la especificidad de acción. Cada enzima sólo realiza un tipo de reacción química, o sea ,la que le permite sus aminoácidos catalíticos (debilitar los enlaces o exponer ciertos grupos químicos que se van a a enlazar)
3Cofactores y vitaminas
Hay muchas enzimas que necesitan de sustancias no protéicas para su funcionamiento que se unen débil y momentáneamente a la enzima (no grupos prostéticos unidos). Mantienen una unión covalente, fuerte y permanente.
La palabra cofactor se utiliza cuando se refiere a iones metálicos (Fe, Mg,Mn , Ca, Zn..)que colaboran en la unión o catálisis que raliza la enzima sustrato.
Las coenzimas son moléculas orgánicas que actúan como aceptores temporales de grupos químicos(transportadores de grupos químicos entre sustrato).
Hay unas enzimas que se llaman hidrogenadas que quitan H2al sustrato pero NO le puede conservar para permanecer intactos. Un ejemplo sería la coenzima REDOX.
Otras enzimas se llaman Quinasas y Fosfatasas donde las quinasas toman y las fosfatasas ceden al sustrato enlaces de alta energía en el fosfórico.(enlace de otra energía con otro fósforo). Aceptan coenzimas transportadoras de energía.
ADP+2Pi<--->ATP (moneda energética de la célula)
UTP/ADP/GTP/TTP. Todas las coenzimas redox son derivados de nucleótidos. Todos los seres vivos podemos fabricarlos.
La coenzima A(no derivado de los ácidos nucleicos) no las podemos fabricar. Los encontramos en la dieta, son derivados de las vitaminas.
- VITAMINAS
Las vitaminas se necesitan en muy pequeñas cantidades ya que colaboran con unas enzimas que también trabajan para el metabolismo porque actúan como enzima. Su carencia produce enfermedades carenciales. Los síntomas son el resultado de el déficit de ciertas reacciones metabólicas que son las que necesitan esas reacciones esas coenzimas. Algunas enfermedades carenciales pueden ser: pelagra, escorboto, beri-beri.
Estos síntomas desaparecen en cuanto se añaden a la dieta. Estas enfermedades se denominan avitaminosis. Las vitaminas se clasifican por su composición. Están las vitaminas hidrosolubles y las vitaminas liposolubles.
Las hidrosolubles actúan como coenzimas o grupos protésticos y al ser hidrosolubles se eliminan mediante la orina.
Los liposolubles,por el hecho de no ser hidrosolubles, su exceso produce intoxicación ya que no se elimina de ninguna manera.
4 Mecanismo para aumentar la eficacia enzimática:sistemas multienzimáticos y compartimentación.
La velocidad de las reacciones aumenta cuando las reacciones están acopladas (A-->B--->C), es decir,cuando el producto de una reacción es el sustrato y, con ello mayor velocidad de reacciones.
El mismo efecto se consigue con la compartimentación ya que si las reacciones ocurren en un compartimento se consiguen mayores concentraciones de sustrato que fuera.
Se forman secuentes de reacciones:
A--->B--->C--->D
e1 e2 e3
Todas las enzimas están asociadas en complejas multienzimáticas de reacción que catalizan una secuencia de reacción. Además, también están asociados a membranas y entonces las reacciones ocurren en el orgánulo.
5 Cinética de las reacciones catalizadas por enzimas: ecuación MICHAELIS-MENTEN.
Las reacciones catalizadas por enzima tienen la misma cinética en reacciones geométricas. Pero estas presentan una peculiaridad: saturación de sustrato.
Esto ocurre porque toda la enzima está ocupada y ya no aumenta más la velocidad por más sustrato que se le eche.
La ecuación de Michaelis-Menten explica la cinética enzimática relacionada la velocidad con la concentración de sustrato y ciertas características de la enzima.
Vo=Vmax |s|/Km+|s|
si Vo = ½ Vmax ---> ½ Vmax =Vmax |s|/Km +|s|
entonces... 2|s| = Km +|s|
conclusión:Km=|s|
La Km es aquella concentración de sustrato donde la velocidad de la reacción es la ½ de la velocidad máxima. La Km es también una constante de equilibrio, es la constante de equilibrio de esta reacción.
E+S<--->ES mucho Km = |s|· |e| / es
mucho Km = poca afinidad
Km es inversamente proporcional a la afinidad de E por S.
La Km varía con: cada sustrato, la temperatura , el PH y las coenzimas o cofactores.
La velocidad máxima es característica con cada enzima y también con cada sustrato, temperatura,Ph o coenzimas y cofactores.
La temperatura óptima para que funcione la enzima es 37ºC y el PH óptimo es 6,5 o 7. Todo esto para el mejor funcionamiento.
5.1.Factores que influyen en la velocidad de las reacciones enzimáticas.
-Concentraciones de sustrato y lo sabemos mediante la ecuación M-M. Hay tres fases de velocidad: velocidad igual a la concentración de sustrato, velocidad concentración de sustrato y velocidad distinta a la concentración de sustrato que es igual a la velocidad máxima y la saturación por sustrato.
-PH. Las enzimas tienen un PH óptimo 6,5 - /, Tanto si es alto o bajo PH , la velocidad disminuye.
ClH<--->Cl- + H+ -COOH <---> -COO- + H+
El cambio del PH afecta a la forma de la enzima o proteína, afecta a los aminoácidos de unión y a los aminoácidos catalíticos y todo esto hace que afecte al funcionamiento de la enzima, o sea, a la velocidad de la reacción.
-Temperatura. También existe una temperatura óptima de 37ºC y si la temperatura está por debajo de 37ºC, no se alcanza la energía de activación, que es baja pero no nula.
Si la temperatura aumenta , favorecería la velocidad de reacción pero como son termoábil(sensibles al calor)se produce la desnaturalización.
-Concentración de coenzimas y cofactores si no es baja la concentración de la reacción, se resiente.
6.Clasificación y nomenclatura de las enzimas
Las enzimas se clasifican según su acción química:
-Deshidrogenasas
-Hidrolasas
-Oxidasas
-Descarboxilasas
Se nombran primero con el nombre del sustrato + la acción química asa.
-Succínico deshidrogenasas: quitan hidrógenos.
-Pirúvico descarboxilasas: quitan CO2
-Glucógeno fosforilasa: da fósforo.
Regulación o modificación de la acción enzimática.
Todo esto hace falta porque el medio es cambiante por lo que las necesidades celulares varían.
Se necesita regulación enzimática por economía celular( solo ocurran las reacciones metabólicas necesarias a la velocidad adecuada). Los mecanismos de regulación son la activación/inhibición enzimática por la que realizan los llamados enzimáticos reguladores (alostéricos y modulados covalentemente)
1 Actuación /inhibición enzimática
La velocidad de una reacción catalizada por una enzima dependía de una concentración de sustato y de concentración de coenzimas y cofactores que con ellos se activa y sin ellos no funciona... No es verdadera regulación ; sí lo es la que producen ciertas sustancias inhibidoras capaces de disminuir la velocidad de las reacciones e incluso hacerla cero.
1.1.Inhibición enzimática
Hay una inhibición que es irreversible que es la que produce ciertos insecticidas o el mercurio que son capaces de unirse a ciertos aminoácidos esenciales del enzima covalente permanentemente alternándose irreversiblemente que se los conoce como venenos metabólicos. Las inhibicones reversibles son indistinguibles unas de otras.
1.2.Inhibición competitiva
En ella lo que ocurre es que el inhibidor es muy semejante químicamente al sustrato. El inhibidor compite con el sustrato en la unión centro activo.
E + S ----> ES <--> E +P
E + I ----->ES<--->
Al introducir el inhibidor la velocidad de la reacción no ocurre. Aumento de KM aparente.
Experimmentalmente se puede saber aumentándole la concentración de sustrato y manteniéndose la concentración de inhibidor aumenta la velocidad y disminuye la inhibición.
1.2.Inhibición acompetitiva
En esta el inhibidor no es semejante al sustrato, es decir, no compite con el sustrato por el centro activo. No se combina con el enzima si no el complejo ES.
E + S<--->E + P
ES + I <--->ESI<--->
Este se distingue experimentalmente aumentando la concentración de sustrato y manteniendo constante la concentración de inhibición, disminuye aún más la velocidad y aumenta su inhibición.
1.3.Inhibición no competitiva
Aquí, el inhibidor, se une al enzima pero un lugar distinto del centro activo y y se dan tres reacciones:
E+S<--->ES<--->E+P
E+S<--->ES
ES+I<-->ESS
Esto se compensa mediante experimentos como anteriormente aumentando la concentración de sustrato, de inhibidores y de enzimas. Esto hace que su velocidad permanezca igual.
E+S<-->ES<-->E+P
E+I<--->EI aumenta V osea V=V
aumento ES+I<--->aumento ESI disminuye V
2 Coenzimas reguladoras
Algunas enzimas son reguladores específicamente diseñadas para regular la velocidad de las reacciones. Son capaces en muy poco tiempo de modificar el estado metabólico de las células en muy poco tiempo.
Las enzimas rehuladoras son las enzimas alostéricas y los moduladores covalentemente.
2.1. Alostérico
Etimológicamente significa ``otro sitio´´. Presentan un centro activo alostérico. En ese sitio se encuentra el modulador que puede ser positivo o negativo actuando la enzima. El positivo activa la enzima y la negativa la imactiva.
Los enzimas alostéricos pueden ser monovalentes o polivalentes. Si es polivalente, cada modulador tiene su centro alostérico.
Enzima alostérica L-treonindeshidratasa
Convierte el aminoácido L-Treonin en L-Isolucina. Es la forma que tiene de convertirse. La isolucina es el modulador negativo de la treonina alostérca. Esto sirve para mantener constante la cantidad de isoleucina. Este mecanismo de control se llama retroalimentación M-negativa. Literalmente significa aumentar atrás. La salida influye sobre la entrada (este mecanismo es utilizado en la cisterna). Este mecanismo se utiliza para mantener constante una variable. Esto sirve para regular. Se llama retroalimentación positiva (M+) cuando se maximiza una variable. Esto lo hace cuando quiere una respuesta máxima.
Ejemplo: el deseo sexual de nuestra pareja que las ganas de ambos se alimentan el uno al otro mutuamente hasta acabar en un coito.
Se encuentran al principio de una secuencia multienzimática (una enzima alostñerico regula a otros cuatro, L-treonindeshidratasa)
Si se encuenta en una encrucijada metabólica, esta controla todas las demás, de hecho, si el producto final de cada ecuación establece distintos moduladores (positivos y negativos). Una red de control es una secuencia enzimática cuyo producto final actúa como moduladores del alostérico.
Las enzimas alostéricas tienen una cinética distinta de las enzimas normales.
2.2. Enzimas moduladas covalentemente
Son unas enzimas caracterizadas porque tienen dos formas:
- Una más activa
- Una menos activa
Inconvertibles mediante cambios covalentes de su estructura catalizadas por otras enzimas. Glucógeo fosforilasa.
Glucógeno + ATP ---> G-1-P + ADP + (glucosa)n-1 + H2O
Esta es una reacción esencial ante las situaciones de emergencia porque libera la glucosa de su almacén (glucógeno) ante una emergencia. Por ejemplo: veo un lobo y tengo que correr para que no me pille pero no he comido desde hace 8 horas, entonces utilizo el glucógeno de nemergencia para mover los músculos.
2 formas + actina ---fosforilasa A
Tiene cuatro subunidades, cada una de ellas tiene un resto de serina fosforilasa que forman un enlace éster entre el OH de la serina y el OH del ácido fosfórico.
Forma menos actina--fosforilasa B
Tiene dos subunidades, las salinas de las subunidades no entran fosforilasa.
La transformación de A a B la realizan la enzima glucógenos fosforilasa fosfatasa.
La transformación contraria--->enzima glucógeno fosforilasa quinasa.
Esto permite amplificar enormemente la señal.Así, ante una situación de emergencia segregamos adrenalina. Una molécula de adrenalina acriva miles de fosforilasa quinasa que comienzan a funcionar. Estos fosoforilasas convierte a millonesde fosforilasa B en mil fosforilasa A y miles de fosforilasas A liberan millones de glucosa-1-fosfato que quedan a disposición del músculo.
Ácidos Nucleicos
Concepto e importancia biológica
Las funciones básicas de los seres vivos las catalizan las proteínas cuya síntesis está dirigida y controlada por los ácidos nucleicos. Contienen las instrucciones para la construcción de un organismo a partir de sus proteínas. Poseen un programa que cuando se ejecuta da lugar a un ser vivo que es capaz de nutrirse, relacionarse y reproducirse.
Hay dos tipos de ácidos nucleicos: ADN y ARNs. Ambos son polímeros de unos monómeros que son los nucleótidos.
Lso nucleótidos son los monómeros de los ácidos nucleicos. Cada nucleótido está formado a su vez por tres moñéculas distintas.
-pentosa
Beta -D ribofuranosa (ARN)
Beta -D-desoxirribofuranosa (ADN)
-un ácido ortofosfórico H3PO4
-Un nucleótido se diferencia de otro por sus bases nitrogenadas. Hay dos tipos:
-Púricas(adenina y guanina)
-Pirimidinicas(citosina, timina, y uracilo)
Están caracterizadas por sus muchos dobles enlaces que son resonantes(como el benceno), esto hace que existan muchos electrones que cambien de posición, electrones deslocalizados o libres. Esto produce cargas fluctuantes y esto les permiten a las bases nitrogenadas capturar protones que es una característica esclusiva de las bases del nitrógeno.
Na OH ----> Na+ OH-
NH2 + H2 ---->NH3+
De esta forma se unen cientos y miles de nucleótidos. Por convenio se dice el primer nucleótido de una cadena es el que tiene el carbono 3'-OH libre y el último nucleótido de la cadena sería el carbono 5'fosforilado. Siguiendo este convenio se dice que las cadenas tienen un orden de 3' 5'.
Estructura de los ácidos nucleicos.
La estructura primaria.
El ADN es un polímero lineal del desoxirribonucleótidos 5'MP de adenina, guanina, timina y citosina. Cuando este se pone en un medio acuoso espontaneamente,(igual a la proteína)toma un estado nativo que es su forma esacial, tridimensional y tiene hasta 4 niveles estructurales en la que cada una depende de la anterior. La estructura primaria es la unión de los nucleótidos mediante enlaces fosfodiéster. Dado que los nucleótiodos son diferentes tienen información genética, o sea, tienen orden, secuencias de nucleótidos.
Tienen específicidad de especie y a su vez de individuo. La información genética es igual a la secuencia de nucleótidos e igual a los planos para construír las proteínas.
La estructura secundaria.
Su decubierto fue undirecta y mocambolesca. Chargaff hizo un análisi de ADN y observó que había el mismo número de A/T =G/C =Puri/Piri=1
Dos mujeres estanounidienses llamadas Franklin y Winklin hicieron radiografías y observaron que la estructura del ADN era fibroso y helicoidal. Watson y Crick, dos compañeros de estas les robaro la radiografía y descubrieron el modelo de la doble hélice que explicaba los datos de CHARGAFF, los rayos X y la propiedad de ADN. Según su modelo el ADN forma dos cadenas en héliceenfrentadas por las bases y unidas entre sí por puentes de hidrógeno exactamente igual que una escalera de caracol en la que los pasamanosserían las pentosas y los fósforos y los peldaños las bases enfentadas y unidas por puentes de hidrógeno. Según su modelo es una hélice a derechas , las cadenas son antiparalelas. Las dos cadenas están trenzadas. Para separar las cadenas hay que destrenzarlasy son complementarias A-T y G-C. Esto lo dedujeron de Chargaff y esto lo explicaron porque la A con T y G con C forman juntos el mayor número de puentes de hidrógenos lo que le da la estabilidad que tiene el ADN. También lo explicaban comentando que el diámetro de las cadenas medían 20 A(astrons)
Como las cadenas están unidas por puentes de hidrógeno y son enlaces débiles, esto explica la fácil desnaturalización y renaturalización del ADN(al igual que las proteínas).
Con la estructura terciaria y cuaternaria se debe resolver el problema de como meter cadenas de 1000000 de nucleótidos en un espacio reducido(célula). Este problema es diferente en las procariotas que en las eucariotas.
Las procariotas tienen 1 mm de longitud 0,001mm.
Sin ayuda de las proteínas esta es la estructura terciaria.
El problema de las eucariotas es 1000000 veces mayor que la de los procariotas. Dos metros de ADN dentro de un núcleo 0.000000002 m de diámetro. Esto lo consigue con la ayuda de las proteínas.
Con la división de los bucles al ADN se hace visible. Cuando no es visible y se denomina cromatina y cuando se divide es visible y se denomamina cromátida y a su vez, dos cromátidas son un cromosoma.
Estructuras de los ARNs
Son polímeros lineales de ribonucleicos 5' MP(ribosa)[[Tiene una carga más negativa que el desoxirribonucleótido. Si a esto lo multiplicamos por mil, las cadenas de ARN son más inestables porque tienen muchas más cargas negativas.]] de A, C, G y U a diferencia del ADN que en vez de timina tiene uracilo. El uracilo es también una base pirimidínica. En cuanto a su estructura, los ARNS son monocaternarios( una sola cadena) pero complementaria consigo misma dormando puentes de hidrógeno intracatenarias formando doble hélice(estructura 2ª) junto con no complementarias partes forman las discontinuidades (al igual que las proteínas) formando bucles y el conjunto de estas estructuras (1º y 2º) son la estructura terciaria.
-Succínico deshidrogenasas: quitan hidrógenos.
-Pirúvico descarboxilasas: quitan CO2
-Glucógeno fosforilasa: da fósforo.
Regulación o modificación de la acción enzimática.
En la cinética enzimática hemos visto que se ve modificada por una serie de parámetros generales (concentraciones de sustrato, la concentración de coenzimas o cofactores, el aumento de temperatura y el aumento o descenso de los puentes de hidrógeno). Por ser generales son inespecíficos, afectan a todas las enzimas por lo que no sirven para regular la actividad enzimática.
La verdadera regulación de las reacciones metabólicas a nivel de enzima modificando su velocidad de actuación, a nivel de los genes a partir de los que se sintetizan los enzimas. Esto lo veremos cuando estudiemos los ácidos nucleicos.
Todo esto hace falta porque el medio es cambiante por lo que las necesidades celulares varían.
Se necesita regulación enzimática por economía celular( solo ocurran las reacciones metabólicas necesarias a la velocidad adecuada). Los mecanismos de regulación son la activación/inhibición enzimática por la que realizan los llamados enzimáticos reguladores (alostéricos y modulados covalentemente)
1 Actuación /inhibición enzimática
La velocidad de una reacción catalizada por una enzima dependía de una concentración de sustato y de concentración de coenzimas y cofactores que con ellos se activa y sin ellos no funciona... No es verdadera regulación ; sí lo es la que producen ciertas sustancias inhibidoras capaces de disminuir la velocidad de las reacciones e incluso hacerla cero.
1.1.Inhibición enzimática
Hay una inhibición que es irreversible que es la que produce ciertos insecticidas o el mercurio que son capaces de unirse a ciertos aminoácidos esenciales del enzima covalente permanentemente alternándose irreversiblemente que se los conoce como venenos metabólicos. Las inhibicones reversibles son indistinguibles unas de otras.
1.2.Inhibición competitiva
En ella lo que ocurre es que el inhibidor es muy semejante químicamente al sustrato. El inhibidor compite con el sustrato en la unión centro activo.
E + S ----> ES <--> E +P
E + I ----->ES
Al introducir el inhibidor la velocidad de la reacción no ocurre. Aumento de KM aparente.
Experimmentalmente se puede saber aumentándole la concentración de sustrato y manteniéndose la concentración de inhibidor aumenta la velocidad y disminuye la inhibición.
1.2.Inhibición acompetitiva
En esta el inhibidor no es semejante al sustrato, es decir, no compite con el sustrato por el centro activo. No se combina con el enzima si no el complejo ES.
E + S<--->E + P
ES + I <--->ESI
Este se distingue experimentalmente aumentando la concentración de sustrato y manteniendo constante la concentración de inhibición, disminuye aún más la velocidad y aumenta su inhibición.
1.3.Inhibición no competitiva
Aquí, el inhibidor, se une al enzima pero un lugar distinto del centro activo y y se dan tres reacciones:
E+S<--->ES<--->E+P
E+S<--->ES
ES+I<-->ESS
Esto se compensa mediante experimentos como anteriormente aumentando la concentración de sustrato, de inhibidores y de enzimas. Esto hace que su velocidad permanezca igual.
E+S<-->ES<-->E+P
E+I<--->EI aumenta V osea V=V
aumento ES+I<--->aumento ESI disminuye V
2 Coenzimas reguladoras
Algunas enzimas son reguladores específicamente diseñadas para regular la velocidad de las reacciones. Son capaces en muy poco tiempo de modificar el estado metabólico de las células en muy poco tiempo.
Las enzimas rehuladoras son las enzimas alostéricas y los moduladores covalentemente.
2.1. Alostérico
Etimológicamente significa ``otro sitio´´. Presentan un centro activo alostérico. En ese sitio se encuentra el modulador que puede ser positivo o negativo actuando la enzima. El positivo activa la enzima y la negativa la imactiva.
Los enzimas alostéricos pueden ser monovalentes o polivalentes. Si es polivalente, cada modulador tiene su centro alostérico.
Enzima alostérica L-treonindeshidratasa
Convierte el aminoácido L-Treonin en L-Isolucina. Es la forma que tiene de convertirse. La isolucina es el modulador negativo de la treonina alostérca. Esto sirve para mantener constante la cantidad de isoleucina. Este mecanismo de control se llama retroalimentación M-negativa. Literalmente significa aumentar atrás. La salida influye sobre la entrada (este mecanismo es utilizado en la cisterna). Este mecanismo se utiliza para mantener constante una variable. Esto sirve para regular. Se llama retroalimentación positiva (M+) cuando se maximiza una variable. Esto lo hace cuando quiere una respuesta máxima.
Ejemplo: el deseo sexual de nuestra pareja que las ganas de ambos se alimentan el uno al otro mutuamente hasta acabar en un coito.
Se encuentran al principio de una secuencia multienzimática (una enzima alostñerico regula a otros cuatro, L-treonindeshidratasa)
Si se encuenta en una encrucijada metabólica, esta controla todas las demás, de hecho, si el producto final de cada ecuación establece distintos moduladores (positivos y negativos). Una red de control es una secuencia enzimática cuyo producto final actúa como moduladores del alostérico.
Las enzimas alostéricas tienen una cinética distinta de las enzimas normales.
2.2. Enzimas moduladas covalentemente
Son unas enzimas caracterizadas porque tienen dos formas:
- Una más activa
- Una menos activa
Inconvertibles mediante cambios covalentes de su estructura catalizadas por otras enzimas. Glucógeo fosforilasa.
Glucógeno + ATP ---> G-1-P + ADP + (glucosa)n-1 + H2O
Esta es una reacción esencial ante las situaciones de emergencia porque libera la glucosa de su almacén (glucógeno) ante una emergencia. Por ejemplo: veo un lobo y tengo que correr para que no me pille pero no he comido desde hace 8 horas, entonces utilizo el glucógeno de nemergencia para mover los músculos.
2 formas + actina ---fosforilasa A
Tiene cuatro subunidades, cada una de ellas tiene un resto de serina fosforilasa que forman un enlace éster entre el OH de la serina y el OH del ácido fosfórico.
Forma menos actina--fosforilasa B
Tiene dos subunidades, las salinas de las subunidades no entran fosforilasa.
La transformación de A a B la realizan la enzima glucógenos fosforilasa fosfatasa.
La transformación contraria--->enzima glucógeno fosforilasa quinasa.
Esto permite amplificar enormemente la señal.Así, ante una situación de emergencia segregamos adrenalina. Una molécula de adrenalina acriva miles de fosforilasa quinasa que comienzan a funcionar. Estos fosoforilasas convierte a millonesde fosforilasa B en mil fosforilasa A y miles de fosforilasas A liberan millones de glucosa-1-fosfato que quedan a disposición del músculo.
Ácidos Nucleicos
Concepto e importancia biológica
Las funciones básicas de los seres vivos las catalizan las proteínas cuya síntesis está dirigida y controlada por los ácidos nucleicos. Contienen las instrucciones para la construcción de un organismo a partir de sus proteínas. Poseen un programa que cuando se ejecuta da lugar a un ser vivo que es capaz de nutrirse, relacionarse y reproducirse.
Hay dos tipos de ácidos nucleicos: ADN y ARNs. Ambos son polímeros de unos monómeros que son los nucleótidos.
Lso nucleótidos son los monómeros de los ácidos nucleicos. Cada nucleótido está formado a su vez por tres moñéculas distintas.
-pentosa
Beta -D ribofuranosa (ARN)
Beta -D-desoxirribofuranosa (ADN)
-un ácido ortofosfórico H3PO4
-Un nucleótido se diferencia de otro por sus bases nitrogenadas. Hay dos tipos:
-Púricas(adenina y guanina)
-Pirimidinicas(citosina, timina, y uracilo)
Están caracterizadas por sus muchos dobles enlaces que son resonantes(como el benceno), esto hace que existan muchos electrones que cambien de posición, electrones deslocalizados o libres. Esto produce cargas fluctuantes y esto les permiten a las bases nitrogenadas capturar protones que es una característica esclusiva de las bases del nitrógeno.
Na OH ----> Na+ OH-
NH2 + H2 ---->NH3+
Nucleótido
Todo junto se denomina nucleótido 5' monofosfato. Estos se pueden unir a otras moléculas formando compuestosde gran importancia biológica.
Compuestos derivados de los nucleótidos
AMP----->adenosinmonofosfato
ADP------>adenosindifosfato
ATP------->adenosintrifosfato
Los tres son portadores de energía.
Los nucleódidos se pueden unir con más fosfatos para dar lugar a lo anterior. A partir del segundo enlace éster el enlace es de alta energía debido a que tiene cargas negativas OH- + OH- y cargas iguales se repelan.(repulsión de energía)
Estos enlaces sirven, por ello, para almacenar energía. Se rompen fácilmente por hidrólisis y liberan energía que necesitan para formarse por eso actúan como coenzimas transportadoras de energía aue necesitan formarse energía química de enñace, única forma de nergía utilizable por los seres vivos.
AMPc(cíclico)
Es el derivado del AMP y es el nucleótido de adenina normal.
Se conoce como segunda mensajera, es un mediador entre moléculas extracelulares portadoras de información (hormonas o neurotransmisores) y el interior de la célula donde tiene su efecto.
La hormona es el responsable de la respuesta celular a través del AMPc por eso la llamamos 2ª mensajera.
Nucleótidos 5'MP más otras moléculas.
Cuando se unen con otras moléculas forman: NAD+, FMN+, NADP, FAD+. todas son coenzimas redox, coenzimas transportadoras de electrones.
Enlace fosfodiéster o enlace nucleosídico.
Es el enlace que une a los nucleótidos.
Estructura de los ácidos nucleicos.
La estructura primaria.
El ADN es un polímero lineal del desoxirribonucleótidos 5'MP de adenina, guanina, timina y citosina. Cuando este se pone en un medio acuoso espontaneamente,(igual a la proteína)toma un estado nativo que es su forma esacial, tridimensional y tiene hasta 4 niveles estructurales en la que cada una depende de la anterior. La estructura primaria es la unión de los nucleótidos mediante enlaces fosfodiéster. Dado que los nucleótiodos son diferentes tienen información genética, o sea, tienen orden, secuencias de nucleótidos.
Tienen específicidad de especie y a su vez de individuo. La información genética es igual a la secuencia de nucleótidos e igual a los planos para construír las proteínas.
La estructura secundaria.
Su decubierto fue undirecta y mocambolesca. Chargaff hizo un análisi de ADN y observó que había el mismo número de A/T =G/C =Puri/Piri=1
Dos mujeres estanounidienses llamadas Franklin y Winklin hicieron radiografías y observaron que la estructura del ADN era fibroso y helicoidal. Watson y Crick, dos compañeros de estas les robaro la radiografía y descubrieron el modelo de la doble hélice que explicaba los datos de CHARGAFF, los rayos X y la propiedad de ADN. Según su modelo el ADN forma dos cadenas en héliceenfrentadas por las bases y unidas entre sí por puentes de hidrógeno exactamente igual que una escalera de caracol en la que los pasamanosserían las pentosas y los fósforos y los peldaños las bases enfentadas y unidas por puentes de hidrógeno. Según su modelo es una hélice a derechas , las cadenas son antiparalelas. Las dos cadenas están trenzadas. Para separar las cadenas hay que destrenzarlasy son complementarias A-T y G-C. Esto lo dedujeron de Chargaff y esto lo explicaron porque la A con T y G con C forman juntos el mayor número de puentes de hidrógenos lo que le da la estabilidad que tiene el ADN. También lo explicaban comentando que el diámetro de las cadenas medían 20 A(astrons)
Como las cadenas están unidas por puentes de hidrógeno y son enlaces débiles, esto explica la fácil desnaturalización y renaturalización del ADN(al igual que las proteínas).
Con la estructura terciaria y cuaternaria se debe resolver el problema de como meter cadenas de 1000000 de nucleótidos en un espacio reducido(célula). Este problema es diferente en las procariotas que en las eucariotas.
Las procariotas tienen 1 mm de longitud 0,001mm.
Las eucariotas se superenrrollan la cadena de ADN y la cierran sobre sí que es igual a la cromasa circular.
El problema de las eucariotas es 1000000 veces mayor que la de los procariotas. Dos metros de ADN dentro de un núcleo 0.000000002 m de diámetro. Esto lo consigue con la ayuda de las proteínas.
Con la división de los bucles al ADN se hace visible. Cuando no es visible y se denomina cromatina y cuando se divide es visible y se denomamina cromátida y a su vez, dos cromátidas son un cromosoma.
Estructuras de los ARNs
Son polímeros lineales de ribonucleicos 5' MP(ribosa)[[Tiene una carga más negativa que el desoxirribonucleótido. Si a esto lo multiplicamos por mil, las cadenas de ARN son más inestables porque tienen muchas más cargas negativas.]] de A, C, G y U a diferencia del ADN que en vez de timina tiene uracilo. El uracilo es también una base pirimidínica. En cuanto a su estructura, los ARNS son monocaternarios( una sola cadena) pero complementaria consigo misma dormando puentes de hidrógeno intracatenarias formando doble hélice(estructura 2ª) junto con no complementarias partes forman las discontinuidades (al igual que las proteínas) formando bucles y el conjunto de estas estructuras (1º y 2º) son la estructura terciaria.
Tipos de ARN
1)ARNm (mensajero)
Es monocatenario, sólo tiene estructura primaria. Tiene una estructura primaria en relación líneas con la estructura primaria del ADN,que son complementarias. Lo que hace es que copia la información genética del ADN, su código genético y lo transmite a la célula(lo lleva hasta los ribosomas encargados de fabricar las proteínas)
El ARNm tiene pocos minutos de vida antes de ser degradado, eso es lo óptimo,lo adecuado,de otro modo la proteína fabricaría indefinidamente.
Como todos los ARNs se fabrican en el núcleo a partir del ADN y realizan su función en el citoplasma. El ARNm constituye entre el 3-5% del ARN total.
2)ARNr(ribosómico)
Es monocatenario también. Constituye entre el 80-85% del total de ARN(el más abundante). Con una estructura primaria con partes complementarias donde forma doble hélice (estructura 2º)y discontinuidades que en conjunto son su estructura terciaria (lo dicho al principio de los ARNs).
Los distintos ARNr se cambian con unos 70 proteínas para formar los ribosomas, que es el único orgánulo macizo que posee la célula cuya función es leer el código genético de ARNm y fabricar la proteína expresanda en ese gen( los ribosomas leen y trducen el código genético).
3)ARNt(transferente)
Son del orden del 10% total de los ARNs celulares. Son pequeñas moléculas que tiene un 80% de bases complementarias dentro de su cadena entre las que se forman una doble hélice y bucles(estructura secundaria)formando la típica estructura en bumerang.
Los ARNt son específicas de aminoácidos (cada ARN tiene Aa o viceversa) que se une por su extremo 3' a una adenina (siempre ACC)(fig8).
También son específicos de Anticodón (el triplete complementario del codón correspondiente de ese Aa). El anticodón de AAA será UUU.
También se forman en el núcleo, a partir del ADN, donderealizan su función( que es transportar su Aa hasta los ribosomas, donde son ensamblados en el orden indicando en el ARNm, en el gen del ADN)
Genética molecular
Funciones biológicas de los ácidos nucléicos.
El ADN se divide en una serie de fragmentos que son los genes, estos contienen la información genética para fabricar las proteínas (planos para la construcción de la proteína). Todos los genes además de significar (fabricar) una proteína, también significa ARNs RyT.
A todo esto se llama Código Genético (linfo genética). El código genético es un idioma formado por letras : ATCG estas forman ``palabras´´(tantas palabras como conceptos expresan). Si hay 20 Aa distintos, hay 20 palabras distintas.
1 letra --->4Aa distintos.
2 letras(4^(2)) --->16 Aa distintos (por las combinaciones que puede haber).
Las combinaciones con repeticiones de 4 elementos de 3 letras = 4^(3) = 6^(3) palabras distintos -->triplete/codón.
Las palabras se asocian para formar frases con sentido completo--->La información de la proteína completa o ARNr,t ,y esto es el gen.
|A
|T--->Aa1 La unión de todos los Aa forman la proteína completa...Recordemos que todo
|C sirve para eucariota y procariota.
|A
|G--->Aa2
|G
|C
|A---->Aa3
|T
ADN
En las procariotas son contínuos como el dibujo de arriba.
En los eucariotas los genes son discontínuos.
Los exones son significativos(no todo lo que dice tiene sentido; unas no sirven para fabricar proteínas)
Los intrones, 90% de la chatarra genética. Su función es estructural, de relleno. Es un seguro contra las mutaciones ya que existe gran probabilidad de caer en intrones.
Maduración del ARNm para eliminar ls intrones.
Características del código genético.
El códifgo genético:
-Es universal para todos los seres vivos(desd virus, hasta nosotros). Esto quiere decir que todos procedemos de un antecedente común.
-Es no solapado (cada base pertenece sólo a un triplete)
-No tiene puntos ni comas. Tiene señales de indicación. AUG y de determinación UGA, UAA, AAG...
-Es degenerado. Un mismo Aa está determinado por varios codones. Por ejemplo: Leucina está determinado por 4 tripletes: CUC/CUG/CUU/CUA pero esto no quiere decir que sea imperfecto. Imperfecto sería si un codón significase varios Aa distintos.
Es degenerado para facilitar la síntesis de proteínas, es decir, la complementariedad codón/anticodón sólo afecta a las dos primeros bases, la tercera se tambalea,lo que facilita la llegada y salida de los ARNt, como debe ser, a los ribosomas durante la síntesis de proteína.
El ARN ribosómico:Necesitan que los ARNt entren y salgan. Si fueran 3 complementarios, launión sería tan fuerte que se quearía una ARNm siempre.
Transcripción.
La primera estructura del ADN determina la secuencia de los aminoácidos de las proteínas( su estructura primaria). Se podría hacer directamente pero no se hace porque el ADN es enorme y además están en el núcleo mientras los ribosomas que son los que sintetizan las proteínas, están en el citoplasma así que se fabrica el intermedario el ARNm que lleva la información de ña estructura primaria del ADN desde el núcleo hasta los ribosomas.
La síntesis del ARN mensajero es la transcripción (por extensión la síntesis de todos los ARNs).
La transcripción consiste en la síntesis de un ARN complementario( A/U ,C/G ,G/C ,T/A).
La transcripción la realiza los ARN polimerasas a ARN dependiente.
Las ARN polimerasas se fijan regiones promotoras(T,A... distinto procariota y eucariota) y esto hace que desenrrolla una vuelta de hélice y utiliza una de las 2 cadenas de ADN como molde para formar una cadena de ARN complementaria.
Al avanzar desenrrolla otra vuelta de hélice y la anterior se vuelve a enrrollar. Así funciona hasta que llega al final del gen en el que se desprende la polimerasa. Este proceso es semejante a los procariotas y en los eucariotas y es que los genes procariotas son contínuos , y entonces el ARNmensajero no necesita maduración, puede ser directamente traducido por los ribosomas (ARNt y siempre maduración postranscripción). En las células eucariotas los genes sin discontínuos.
El 90% son intrones y no dicen nada, sin sentido.
Exones 10%, con sentido.
No puede ser traducido directamente sino que necesita una maduración para eliminar los intrones. La maduración la realizan unas enzimas que son ribonucleoproteínas pequeñas nucleares RNPpn. Como su propio nombre indica, está formado por proteínas y ARN que es complementario con las secuencias iniciales y finales de los finales de los intrones cortándolos.
El unir los exones lo hace una proteína que se llama polimerasa (ligasa)
Las ADN polimerasa sólo puede utilizar como molde la cadena 3'5' se lee desde abajo. Se fija para formar una cadena de ARNmensajero complementaria pero este ARNm es antiparalelo. Si esto es así el comienzo de el ARN es 5' 3' en los eucariotas. Después de que se haya formado algunos (30) ribonucleótidos al extremo 5' se le pone una caperuza de 7-metilguanosina trisfosforilada, esto se hace para reconocer el comienzo del gen por los ribosomas.
En el 3' del ARNm se le añaden 200 ribonucleótidos de adenina. A esto se le llama la cola poliadenina.
Los eucariotas tenemos 3: los ARN polimerasas I(síntesis ARN r), la ARN polimerasa 2 (síntesis ARNm) y la ARN polimerasa 3 para el transferente.
3Duplicación, autoduplicación y replicación del ARN.
El ADN tiene la información genética. Cada vez que la célula se divida antes tiene que formarse una nueva copia idéntica para repartir entre las dos células hijas.
En 1953 la doble hélice de ADN cuando Watson y Crick sacaron su modelo, propusieron el mecanismo de duplicación de las cadenas de ADN. El mecanismo de duplicación de las cadenas de ADN. El mecanismo consistía en que de la cadena 5' 3' se formaban otra y de la 3'5' otra cadena, complementaria.
(Separación semiconservativa.)
Hay una cadena nueva y una cadena vieja.
Por aquel entonces había otra hipótesis que era conservativa. Según esta se separaban y las cadenas iniciales se conservan.
La hipótesis dispersiva decía que las cadenas iniciales se fragentaban y las nuevas aparecían en las células hijas.
La duplicación (de la semiconservativa) ocurría al final de la interfase en la llamada fase Fase S.
[El ciclo celular son las fases por las que pasa una célula en su vida que son la interfase (99,5% de su vida, sus funciones). Al final de su vida entra en división (0,5% de su vida)]
Antes de entrar en división , al final de la interfase se duplica en la Fase S. La duplicación consiste en duplicar el ADN polimerasa que utiliza como molde las cadenas de ADN para formar nuevas cadenas complementarias.
La ADN polimerasa I y II son las enzimas más complejas de la naturaleza.
La ADN polimerasa I tiene varios centros activos. Uno de esos centros se une a la cadena molde. Otro centro activo se une al nuevo nucleótido que colocó en la cadena de formción.
Por otro centro activo se une al nuevo nucleótido que se va a incorporar en la cadena de formación que es trifosforilado y complementario con el molde (si es así forma enlace éster 5'3').
Esta enzima además tiene actividad exonucleásica (que mira atrás) y si ha habido un error (no complementario con el molde) lo corta y rellena el neuvo correctamente.
El proceso de duplicaciónes semejante en las eucariotas y en los procariotas comienza porel origen de replicación. En este origen se separan las cadenas complementarias y progresa esta duplicación o lo largo, de la cadena como una orquilla de replicación que progresa como una cremallera al abrirse.
Los ADN polimerasa les ocurren lo mismo que a las ARN polimerasa y es que sólo saben utilizar como molde la cadena 3'5'. Esto hace que la cadena 3'5' se duplique de una forma, hebra conductorabsíntesis contínua y la otra la hebra retardada 5'3' de dirección contraria y su síntesis es discontínua y más lenta.
Los ARN polimerasas ``saben´´ comenzar una cadena y las ADN polimerasas no, sólo continuar una cadena que ya está empezada. De esta manera la duplicación comienza , con un ARN cebador que se llama PRIMER que está sintetizado por la primasa (ARN polimerasa) que luego continua la ADN polimerasa III.
El trozo que se corta es el primer y se rellena el hueco dejado por el ARN cebador por el ADN polimerasa I además se unen los fragmentos mediante una ligasa. Esto se hace una vez en la hebra conductora y más veces en la hebra retardada.
El fragmento se llama el fragmento de OKAZAKI que es un ADN y un trozo de ARN.
Proteínas enzimáticas que intervienen en la duplicación:
-polimerasas I y III.
-primasa(polimerasa)
-ligasa
También intervienen otras proteínas no enzimáticas como la helicasa que rompe los puentes de hidrógeno del ADN para separar sus cadenas.
La topiosomerasa (doble hélice trenzada)Como las cadenas están trenzadas en la cadena de ADN de doble hélice al separarlas se produce un super enrrollamiento causado por el desenrrollamiento y la topiosomerasa relaja el enrrollamiento producido por las cadenas al estar trenzadas.
Esta cadena es una cadena inestable y la SSB (proteína estabilizadora) estabiliza la cadena (molde) sencilla del ADN.
Esta duplicación es muy compleja pero es rápida. Es rápida siendo compleja (45000 nucleótidos por minuto y , además es muy precisa, sin errores , prácticamente comete un error por cada 1/10-100 x 10^(6) nucleótidos polimerizados)
Si hay un error la ADN polimerasa lo corta y rellena el hueco y la ligasa los une y entre estos dos reparan los errores.
Sin embargo, este sistema no es perfecto, ya que no todos son reparados. (1/10000000000 nucleótidos polimerizados)
Estos errores son mutaciones. Si esta mutación compromete la viabilidad del individuo, te mueres, entonces te perjudica y si no comprometen la variabilidad genética es beneficioso ya que aumenta la variabilidad genética,
Si no hubiera mutaciones, todos los individuos seríamos iguales.
Sin mutación todo sería semejante, con mutación algunos serían distintos y hay variablidad genética.
Si la selección natural cambia (temperatura, condiciones ambientales) los que son semejantes, si muere 1, mueren todos y los que no son semejantes muere sólo un tipo.Esta mutación es la adaptación de la evaluación ante un medio cambiante.
4Biosíntesis de proteínas en procariotasPreviamente a la síntesis de proteínas se debe transcribir su gen en forma de ARNm(transcripción) por parte de la ARN polimerasa II que utiliza como molde la cadena 3'5' del ADN y forma un ARNm que es complementario y antiparalelo a ella, esto sucede en el núcleo,
Al ser antiparalelo el primer nucleótido sería el 5'3'. Después de la transcripción se da la maduración en eucariotas del ARNm transcrito porque tiene intrones. También previamente, los aminoácidos deben ser activados(añade energía para que puedan formar enñaces peptídicos) ya que son enlaces covalentes y son enlaces fuertes, necesitan mucha energía.
El aminoácido necesita energía y unirse a su ARNt. Cada aminoácido necesita energía y unirse a su ARNt que es el complementario de su anticodón. Todo esto lo hace una enzima llamada AMINOACILARNtSINTETASA. Esta enzima hace que:
Aa+ARNt+ATP+2H2O--->ARNtAMINACIL+AMP+2Pi+H2O
El H2O de la derecha aparece de la esterificación del ARNt-O-Aa.
((Aquí hacemos un paréntesis ya que para explicar qué es la biosíntesis de ribosomas tendremos que explicar antes qué es un ribosoma. El ribosoma que explcaremos será el de los procariotas pero sólo vamos a explicar su papel.
Los ribosomas de procariotas hacen referencia a 70s (coeficiente de sedimentación, velocidad a la que caen) mientras que en los de eucariotas son 80s.
Los ribosomas son complejos supramoleculares formados por varios ARNt(65%) más 50 proteínas distintas. Están formadas por dos subunidades que se fabrican por separado en el núcleo(porque tienen ARNr) y salen al citoplasma donde autoensamblan por estereoespecifidad en torno a un ARNm y si no hay ARNm se separan. Cuando esto ocurre aparecen propiedades nuevas en el ribosoma que son la capacidad de interaccionar reversiblemente con otras moléculas (ARNt aminoacil,hidrólisis de GTP o proteínas llamadas factores) que llegan y salen del ribosoma provocando cambios en cada molécula del ribosoma y en el ribosoma completo. Estos cambios desembocan en la síntesis de proteínas. Básicamente los ribosomas favorecen el acceso de los ARNt aminoacl a su codón correspondiente del ARNm(coloca los aminoácidos en su orden (leen ek mensaje y forman enlaces peptídicos entre sus Aa y esto significa que se traducen).))
La biosíntesis consta de 3 partes: iniciación, enlogación y terminación.
4.1. Iniciación.
Primero, la subunidad 30s del ribosoma se coloca en el extremo 5' del ARN ocupando dos tripletes. El primero es AUG que es el codón de iniciación. Es complementari del anticodón de iniciación de un ARNm transferente que lleva el Aa llamado formilmetionina.(es el Aa metionina con su amino bloqueado por formilo) para que no pueda formar enlaces peptídicos.
Entonces la formilmetionina es el primero de la cadena. En los eucariotas siempre empiezan por metillionina.
Por último la subunidad 50s aparece luego (complejo de iniciación). Varios factores de iniciación entran y salen del ribosoma y se hidroliza un GTP.Antes teníamos el complejo de iniciación y en la primer fase de la enlogación, FIJACIÓN,llega el segundo triplete y se coloca el codón ante el anticodón y la hidrólisis de GTP permite la fijación.
La segunda fase de enlogación es LA FORMACIÓN DEL ENLACE PEPTÍDICO (dos factores de enlogación). Lo produce una enzima que se llama la peptiltransferasa (en 50s) y lo que hace es romper el enlace éster de la Fmet. y forma con la energía otro enlace con la listeína.La tercera fase en la TRANSLOCACIÓN. Para que ocurra este paso necesita otro factor de enlogación más la hidrólisis GTP. El ribosoma se desplaza a un triplete en dirección 3'.
El ARNt se desprende y sale por degenerado(G-A no es compatible). A la izquierda está el peptidil porque tiene el ARNt con el péptido en formación y a la derecha está el aminoacilARNt que es donde se ha clocado.
4.3.Terminación.
Este proceso tan complejo permite colocar 1400 Aa por minuto. tras lo cual se degrada el ARNm ,sino, se formaría constántemente la misma proteína.
5 Transcripción en eucariotas.
En los procariotas al principio de cada proteína había un formil-metionina y en eucariotas una metionina. En los procariotas los ribosomas están aislados (una cadena), pero en las eucariotas ,los ribosomas aparecen reunidos.(polisomas-->varias cadenas)
En los procariotas los ribosomas son libres, mientras que en los eucariotas los tienen libres y otros asociados a la membrana que se encuentran asociados en la membrana nuclear o a la membrana del retículo endoplasmático rugoso.
Cuando están asociadas a la membrana, las proteínas se mantienen en el núcleo o en el retículo endoplasmático. Se pega a la membrana el ARNm porque en su extremo 3' posee poliadenina que hace que se oegue a la membrana.
En la cadena 3'5' comienzan ribosomas libres al igual que antes. En este caso hay una diferencia con los procariotas y es que todos los ARNm transcritos a nivel de membrana comienzan por una secuencia de Aa apolares.(secuencia hidrófobica o señal)
Al aproximarse la secuencia hidrofóbica a la membrana, ``atrae´´ a ciertas proteínas intrínsecas de la membrana(apolares) que difundan en torno a la secuencia señal.
Las proteínas intrínseca son apolares y las extrínsecas son polares. Cuando las proteínas intrínsecas se tocan con la secuencia señal, se disuelve la secuencia señal en las proteínas intrínsecas introduciéndose a través de la membrana que es igual a un túnel. La secuencia hidrófoba tiene como función permitir la entrada de la proteína en formación a través de la membrana.
Detrás entra toda la proteína en formación, independientemente de que sea hidrófoba porque la subunidad 60s estabiliza el túnel.( no se cierra)
En ese moemnto se corta la secuencia señal y queda la verdadera proteína. Cuando llega al codón de terminación, se separan las subunidades y desaparece el túnel.
La proteína realmente se encuentra en medio de la cadena de ribosomas ya que al principio sólo se encuentra la secuencia señal y al final sólo se encuentra el poli A para unirlo a la membrana.
6 Regulación de la expresión génica.
Un gen produce proteínas y una proteína determina un carácter biológico como el color el pelo. ¿Se puede regular los caracteres biológicos, la expresión de los genes? Pues sí, a través de las proteínas que lo determinan regulando el funcionamiento de las proteínas regulando ciertos parámetros generales con la temperatura, el PH ,la concentación de soluto, la concentración de coenzimas, etc. Todos estos parámetros son inespecíficos, afectan a todas las proteínas por igual por lo que no son un buen mecanismo de regulación.
Otro mecanismo es mediante la activación/inhibición enzimática. También se puede regular mediante los enzimas reguladores (alostéricos y modulados covalentemente).
A nivel de los ribosomas, modificando la velocidad de transcripción o sin controlar la velocidad de trancripción modificando el post-transcripción (en lugar de fabricar la verdadera prtoteína la vuelvo inactiva hasta que se encuentre con la proteína). Todas estas formas son derrochadoras comparadas con el control de transcripción no se fabrica ni el ARNm y así puede ocurrir las demás cosas.)
El control de la transcripción permite economizar y adaptarse a las codiciones cambiantes del medio.
En las procariotas y eucariotas existe el control de transcripción. En los eucariotas además, hay un control de transcripción(de otro tipo) que permite el proceso en la diferenciaciñon celular.
Diferenciación celular.
Las células se diferencian de su estructura y funcionamiento. La estructura y el funcionamiento van determinadas por las proteínas que poseen. Todas las células poseen el total de la información genética, podrían fabricar el total del organismo.(embriones, células madres)(totipotentes). La diferenciación celular se consigue por la represión irreversible del 90% de su genoma en las primeras fases del desarrollo embrinario.
Esto es un control de transcripción irreversible. La heterocromatina se tiñe, es un ADN empaquetado, inactivo, reprimidp irreversiblemente. La eurocromatina no se tiñe y forma bucles de ADN activo formando proteínas.
Control reversible de la transcripción(en procariotas)
En eucariotas es semejante pero más compleja. La presentan todos los procariotas por estar en contacto con un medio cambiante. También lo presentan algunas células eucariotas,(glóbulos blancos), células del hígado,del riñón, del epitelio(tubo digestivo)... El resto no (neurona muscular) porque el medio es estable, no es cambiante como el medio interno.(homeóstasis). Hay dos tipos de enzima:
-Constitutivos( forman parte de la célula siempre) no tienen control de la transcripción, siempre son necesarios (reproducción celular, fotosíntesis, glucolisis)
-Indivisibles, si tienen control de la transcripción , no siempre son necesarios.
5.1. La teoría de Operón.
Explica el control reversible de la transcripción. La descubrieron Jacob y Manod, eran franceses. Clasificaron las relaciones moleculares y geométricas durante la inducción/represión enzimática reversible. Sirve para cualquier proteína. A partir de datos de otro investigadores con la echerichia coli (e. coli). Otros investigan que la galactosidasa es una enzima inducible reversiblemente (que forma la e.coli). Había una serie de mutantes en e.coli que:
- no forman galactosidas.
- forma alterada.
.como constitutiva.
Hicieron un Mapa Genético con los genes y sustancias responsables de la inducción /represión galactosidasa.
- El gen ``y´´ determina una enzima permeasa.
- El gen ``a´´ determina una enzima tremsacetilasa.
- El gen ``z´´ determina la galactosidasa.
- Secuencia multienzimática para la hidrólisis de lactosa.
- Sirve para cualquier proteína.
- Gen i , p , o son genes reguladores.
- Gen i es el gen inhibidor, forma proteína represora activa. Tiene dos centros activos, uno para el gen y otro para el inductor (lactosa)
- Cuando está el inductor suelto, el gen o. y si no está , está unida al gen o.
- Gen proteñina promotora, señal reconocida por la ARN polimerasa, no transcribir.
- Los genes p, o , z van juntos; los otros no.
- Si la mtación es en z, se produce galactosidasa alterada.
- Mutación en p, no forma galactosidasa.
- Mutación en o , galactosidasa como consitutiva, se fabrica para siempre)
- Mutación en i, constitutiva.

Los genes estructurales contienen la información para la síntesis de las enzimas que intervienen en la ruta metabólica.
Los genes reguladores sintetizan la proteína reguladora. Puede encontrarse en un lugar distinto a los otros genes del operón.
El gen promotor está constituído por la secuencia de ADN donde se une la ARN polimerasa para comenzar la transcripción.
El gen operador es el lugar del ADN donde puede unirse una proteína reguladora e impedir la transcripción de los genes estructurales. Se sitúa inmediatamente delante de estos.
Si hay lactosa o libre se transcribe Z=inducción y si no hay lactosa O está ocupado y no se transcribe Z=represión. Esto se llama inducción/represión de una enzima por catabolito.(molécula del catabolismo).
Justo aquí hay una secuencia multienzimática.(operón lactosa-->teoría de Operón).
Son genes estructurales relacionados entre sí (scuencia multienzimática de la hidrólisis de la lactosa) regulados todos por los mismo genes reguladores.
Este mismo modelo nos sirve para explicar la inducción/represión de una enzima o secuencia multienzimática por el producto final.
Para explicar el producto final hay que entender que el gen inhibidor produce una proteína represora inactiva más el correpresor(producto final). Con producto final no se transcribe porque el gen O queda libre y hay transcripción. Con producto final se vuelve proteína represora activa.
Esto es retroalimentación represiva.
La bacteria si come lactosa/glucosa(enzimas consitutivas). Se come lo que puede digerir. El gen p junto proteína aceptora del AMPc, están las tres y se transcribe, que falta uno, pues no se transcribe.









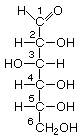








































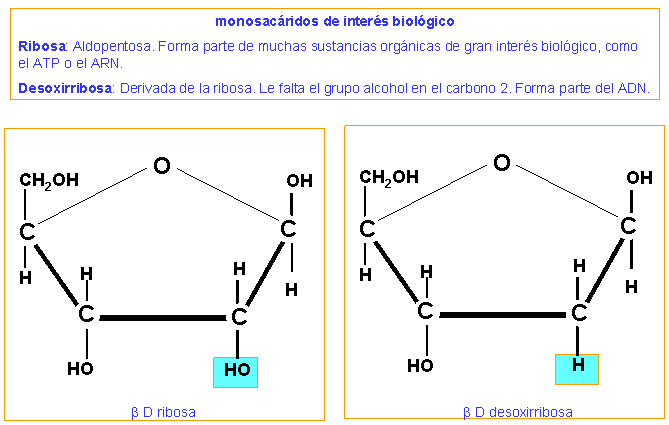











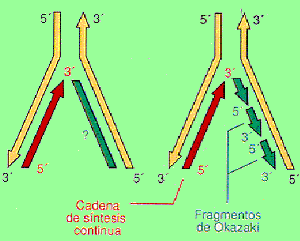

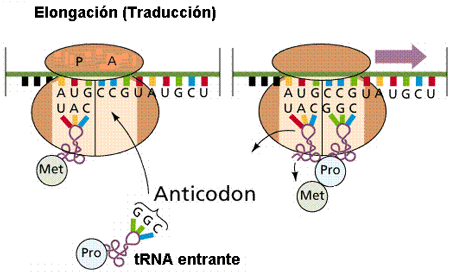




No veas JUAN lo que me ha costado...esto merece un premio!!!4 horas...!!
ResponderEliminarEsto es exactamente lo que te quería decir en el otro comentario, antés de ver esto , aunque todo es mejorable. está muy bien y por supuesto merece un premio. ¿Por cierto donde están las cuestiones?
ResponderEliminarNo he encontrado las cuestiones de selectividad y debían de estar imprescindiblemente. ¿Qué hacemos ahora?
ResponderEliminarOk el proximo trimestre lo are es que tampoco se muy bien como va esto y nose si es para todo el mundo pero cada dos por tres se queda cojido por eso he tardado tanto .. bueno los proximos les metere como has dicho videos y enlaces gracias y siento la tardanza!!
ResponderEliminarya he conseguido solucionar el problema que tenia, en vez de subir una entrada nueva cada dos por tres lo he metido todo en la primera en esta que no se te olvide mirarla aqui que si que lo he hecho!!jeje
ResponderEliminarUn trabajo impresionante que no era obligatorio pero si te sirve me vale a mi también. Aunque resulta inmanejable, debes hacer separaciones entre unos temas y otros. El aspecto gráfico está muy bien en la presentacion del blog aunque en los temas que también hecho en falta videos, link .... y otras herramientas que permita el blog.
ResponderEliminarsoy profesora de ciencias y tu trabajo me encanta esta muy completo. felicidades
ResponderEliminargraciass!!me ha alegrado un montón!ojala mi profesor lo tenga en cuenta :P!
ResponderEliminarPlay Coin Casino Online for FREE ᐈ No Deposit Required
ResponderEliminarNo Deposit Bonus 코인카지노 가입코드 Code is needed to play Coin Casino Online for FREE. ⭐ No Deposit Required. Play casino games in real money, Mobile friendly.